Introduction
Processus élémentaire, mécanisme
Les concepts d'équation bilan, de réaction élémentaire et de mécanisme ont déjà été introduits au chapitre 1 : Les concepts fondamentaux. Ils sont repris et approfondis ici comme préalables à l'étude de la théorie de la réaction chimique.
Rappelons que l'équation bilan n'indique rien sur la manière intime dont les molécules réagissent les unes sur les autres pour former les produits de la réaction. Elle ne traduit qu'un bilan macroscopique à la fois :
qualitatif (quelles sont les substances qui réagissent - les réactifs - et quelles sont celles qui se forment - les produits)
et quantitatif (dans quelle proportion ces substances réagissent entre-elles.
La nature des réactifs et des produits est spécifiée par leur formule.
La proportion avec laquelle ils réagissent est spécifiée par les coefficients stœchiométriques.
Définition :
On appelle réaction élémentaire (ou processus élémentaire) une réaction qui, au niveau microscopique, ne peut pas être décomposée en réactions plus simples.
Une réaction élémentaire se déroule donc par interaction directe des réactifs se produisant en une seule étape.
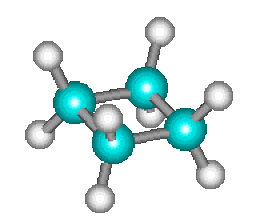
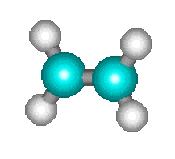
Par exemple, nous avons déjà cité au chapitre 1 (Les concepts fondamentaux) la réaction de décomposition du cyclobutane en deux molécules d'éthylène qui s'effectue sans que l'on puisse mettre en évidence des étapes ou des intermédiaires.
\(=\)
\(+\)

Une telle réaction, qui fait intervenir une seule molécule comme réactif, est dite monomoléculaire.
Il en est de même pour d'assez nombreuses réactions d'isomérisation comme celle du cyclopropane en propène :
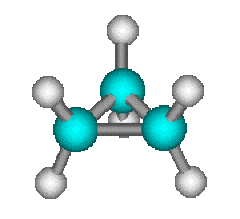
\(\mathbf{\longrightarrow}\)
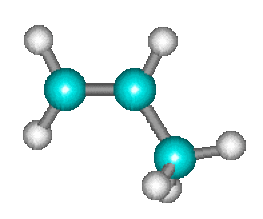
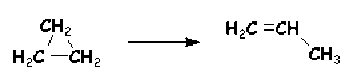
La réaction de transfert d'un atome d'oxygène \(\mathbf{\textrm{NO} + \textrm O_3 = \textrm{NO}_2 + \textrm O_2}\) s'effectue également directement par transfert d'un atome d'oxygène en une seule étape.
Les réactions de Diels Alder telle que :
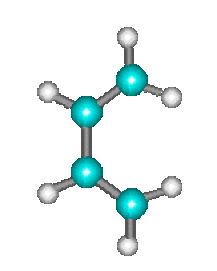
\(+\)
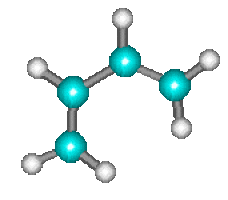
\(\longrightarrow\)
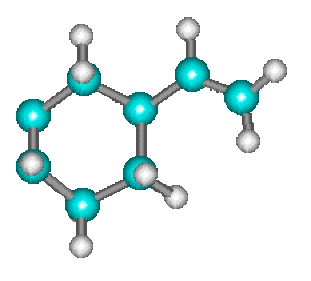
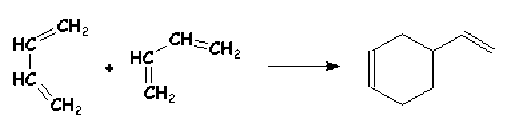
s'effectuent également en une seule étape au cours de laquelle les liaisons \(p\) se rompent tandis que les liaisons \(s\) se forment simultanément.
Les réactions élémentaires qui, comme les deux précédentes, font intervenir deux molécules comme réactifs, sont dites bimoléculaires. Les processus bimoléculaires sont de loin les plus fréquents. Ils se produisent par la rencontre de deux entités, chacune étant animée d'une énergie cinétique. L'étude des processus bimoléculaires en phase gazeuse a servi de base au développement des théories de la réaction chimique.
Les processus monomoléculaires sont moins fréquents. Dans bien des cas, une étude plus approfondie a montré que certaines réactions que l'on considérait comme étant monomoléculaires ne l'étaient pas véritablement.
Les processus trimoléculaires sont beaucoup plus rares car il supposent la rencontre simultanée de trois entités, ce qui est statistiquement très improbable. On tend à considérer actuellement que les réactions trimoléculaires n'existent pas et que c'est seulement notre incapacité à aller voir de plus près comment ça se passe au niveau moléculaire qui ne nous permet pas de distinguer des étapes plus simples.
On ne connaît pas de réaction élémentaire faisant intervenir simultanément plus de trois entités.
Réactions complexes, mécanisme
La plupart des réactions ne sont pas des processus élémentaires. Elle s'effectuent en plusieurs étapes successives ou concomitantes. De telles réactions, résultant de plusieurs processus élémentaires, sont appelées réactions composées ou complexes selon leur degré de complexité.
On appelle mécanisme l'ensemble des réactions élémentaires qui rendent compte convenablement du déroulement d'une réaction. Un mécanisme est donc une hypothèse qui doit être conforme à l'ensemble des observations expérimentales disponibles.
En particulier, un mécanisme doit traduire correctement la stœchiométrie de la réaction et être compatible avec la loi de vitesse déterminée expérimentalement.
Considérations introductives à la théorie de la réaction chimique.
La théorie de la réaction chimique a pour objectif de décrire aussi précisément que possible les processus élémentaires tels qu'ils se déroulent au niveau microscopique et de relier ses résultats aux observations que l'on peut faire au niveau macroscopique.
Ces observations portent :
d'une part sur la variation des grandeurs thermodynamiques entre l'état initial et l'état final
et d'autre part sur les caractéristiques cinétiques de la réaction (ordre observé, valeur des coefficients de vitesse, influence de la température).
De par sa nature même, toute réaction chimique entraîne la rupture de liaisons dans les réactifs et la formation de nouvelles liaisons dans les produits.
On comprend dès lors que pour décrire correctement le déroulement d'une réaction chimique on doive utiliser la mécanique quantique. En effet, elle seule fournit le cadre conceptuel adéquat pour décrire les systèmes moléculaires lorsqu'on veut tenir compte explicitement des électrons.
A ce stade, on rencontre une difficulté méthodologique incontournable.
Dans l'état actuel des connaissances, pour les systèmes moléculaires qui intéressent la Chimie, la mécanique quantique ne permet de traiter que des systèmes stationnaires. C'est à dire que l'on ne sait pas prendre en compte explicitement le facteur temps dans un traitement quantique des molécules.
Pour décrire une transformation, on devra donc décomposer celle-ci en une série d'états stationnaires que l'on cherchera à décrire. Un peu comme on décompose un mouvement par une série de clichés fixes.
Pour ce faire, il faut définir cette série d'états intermédiaires entre l'état initial et l'état final. On appelle chemin réactionnel cette suite d'états.
En pratique, on se limitera à l'étude de certains états particuliers constituant des maxima ou des minima d'énergie le long du chemin réactionnel.
Une deuxième difficulté tient à la lourdeur de la description d'un système (même stationnaire) par la mécanique quantique.
Pour obtenir une description assez fine, on doit recourir à des méthodes très élaborées qui ne peuvent s'appliquer qu'à des systèmes de très petite taille.
Aussi cherche-t-on à décrire l'évolution du système en cours de réaction avec des modèles plus simples dans lesquelles les molécules peuvent être traitées avec les lois de la mécanique classique. Il n'est des lors pas étonnant que les premières tentatives d'interprétation de la réaction chimique ait été développées pour les réactions en phase gazeuse, en s'appuyant sur la théorie cinétique des gaz.