Introduction
Dans le chapitre Approche formelle , vous avez vu le cas des réactions simples qui obéissent à des lois de vitesse d'ordre 1 ou 2.
Si vous n'avez pas encore avez étudié le chapitre 2, il est nécessaire de le faire avant d'aborder l'étude des réactions composées.
Une réaction dite simple est une réaction unique qui obéit à une loi de vitesse d'ordre entier.
Une réaction dite composée est la résultante de plusieurs réactions simples se produisant simultanément dans le milieu réactionnel.
Dans ce qui suit nous nous limiterons à l'étudee des réactions composées de deux réactions simples toutes deux du premier ordre.
Mais il est évident que dans une étude plus complète, il faudrait aussi considérer les cas où interviennent plus de deux réactions dont les ordres peuvent être différents de un.
On distingue trois classes de réactions composées :
les réactions séries
les réactions opposées
les réactions parallèles
Les réactions séries (dites aussi réactions consécutives) sont constituées de deux réactions dont la seconde a pour réactif le produit de la première. On peut les schématiser par :
\(\mathbf{\textrm A\to\textrm B}\) et \(\mathbf{\textrm B\to\textrm C}\)
que l'on écrit souvent
\(\mathbf{\textrm A\to\textrm B\to\textrm C}\)
Les réactions opposées (dites aussi réactions incomplètes) sont constituées de deux réactions dont les réactifs de l'une sont les produits de l'autre. On peut les schématiser par :
\(\mathbf{\textrm A\to\textrm B}\) et \(\mathbf{\textrm B\to\textrm A}\)
que l'on écrit souvent
\(\mathbf{\textrm A^\to_\gets\textrm B}\)
Les réactions paralèlles (dites aussi réactions compétitives) sont constituées de deux réactions ayant les mêmes réactifs mais formant des produits différents. On peut les schématiser par :
\(\mathbf{\textrm A\to\textrm B}\) et \(\mathbf{\textrm A\to\textrm C}\)
que l'on écrit souvent
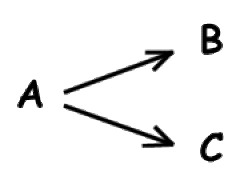
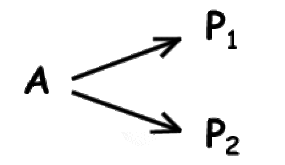
Souvent on note les produits \(\textrm P_1\) et \(\textrm P_2\) l'indice se référant au numéro de la réaction :
Cliquez ici[1] pour avoir une remarque sur la stoëchiométrie des réactions composées.