Introduction
Les réactions dites complexes sont des réactions faisant intervenir plusieurs types de réactions composées.
Considérons par exemple la réaction d'hydrolyse basique d'un diester :
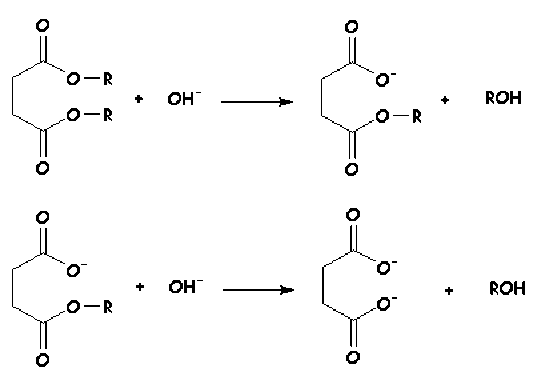
Pour simplifier l'écriture, notons
\(\textrm D\) le diester
\(\textrm M\) le monoester, carboxylate et
\(\textrm C\) le dicarboxylate.
\(\mathbf{\displaystyle{\begin{array}{cccccc} \textrm D+\textrm{OH}^- & \to & \textrm M+\textrm{ROH} \\ \textrm M+\textrm{OH}^- & \to & \textrm C+\textrm{ROH} \end{array}}}\)
Ce système est seulement constitué de deux réactions qui peuvent être considérées comme élémentaires, mais elles sont à la fois :
Séries en ce qui concerne le substrat :
\(\mathbf{\textrm D\to\textrm M\to\textrm C}\)
Parallèles en ce qui concerne l'ion hydroxyle.
De ce fait, sauf si on se place dans des conditions particulières, le système est considéré comme complexe.
S'il est relativement facile d'écrire les lois de vitesse sous leurs formes différentielles, leur intégration est difficile, parfois même impossible.
Les lois de vitesse, sous leurs formes intégrées, sont difficiles à exploiter.
Cliquez ici[1] pour obtenir des détails sur les lois de vitesse de cette réaction.
Du fait de ces difficultés, on cherche à simplifier l'étude des réactions complexes :
Soit en se plaçant dans des conditions particulières.
Cliquez ici[2] pour voir une de ces conditions particulières.
Soit, lorsque c'est possible, en appliquant des approximations simplificatrices.
Ces approximations sont présentées au paragraphe suivant.