Introduction
La mésomérie se base sur le modèle quantique appelé modèle des liaisons de valence. Ce dernier repose sur une interprétation orbitalaire de la structure électronique des molécules. Il définit la liaison covalente à deux électrons comme résultant du recouvrement de deux orbitales atomiques polarisées (hybridées) portant chacune un électron.
La répartition des électrons sur les orbitales disponibles conduit alors à définir les paires non liantes, les paires liantes et les vacances électroniques (cases vides). Cette répartition définit aussi une fonction d'onde que l'on appellera fonction mésomère.
Cette fonction est construite à partir d'orbitales « hybridées ». On donne ci-dessous les schémas d'hybridation pour les molécules d'eau, d'hydrure de bore et d'éthylène :

Schéma d'hybridation de l'eau. L'oxygène est hybridé sp3
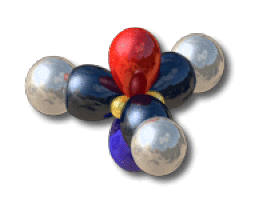
Schéma d'hybridation de l'hydrure de bore. Le bore est hybridé sp2
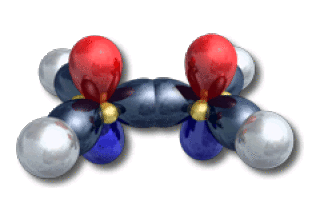
En général, le schéma d'hybridation se déduit des règles VSEPR. Par exemple, l'oxygène dans l'eau est de type \(\textrm{AX}_2\textrm E_2\). La figure de répulsion est tétrahédrique ; le schéma d'hybridation adapté est alors \(\textrm{sp}^3\). Le bore dans l'hydrure de bore est de type \(\textrm{AX}_3\). La figure de répulsion est inscrite dans un triangle ; le schéma d'hybridation adapté est alors \(\textrm{sp}^2\). Il en est de même pour les carbones dans l'éthylène.