Formules limites de résonance
Partie
Question
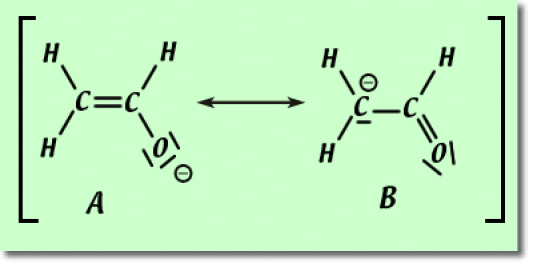
1. Il existe deux formules de résonance pour l'ion énolate. Indiquer la structure la plus contributive en justifiant votre réponse.
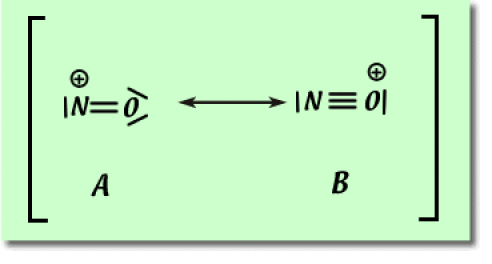
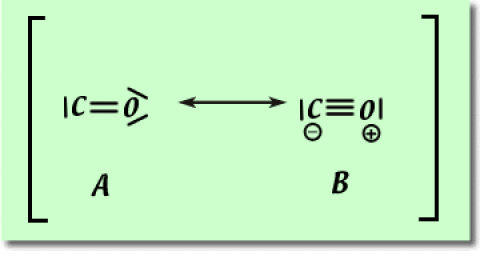
2. Écrire les structures de résonance pour le monoxyde de carbone \(\textrm{CO}\) et du cation \(\textrm{NO}^+\). Indiquez la structure la plus contributive dans chacun des cas en justifiant votre réponse.
Aide méthodologique
Pour déterminer la formule limite la plus contributive, il faut utiliser les trois critères relatifs dans l'ordre de priorité suivant :
Critère 1 : la formule la plus contributive est celle qui présente un nombre maximal d'octets pour chaque atome constituant cette structure.
Critère 2 : le critère précédant n'étant pas discriminant, la formule la plus contributive est celle dont les charges sont en concordance avec l'électronégativité des atomes qui portent ces charges.
Critère 3 : les deux critères précédant n'étant pas discriminants, la formule la plus contributive est une structure neutre ou la formule pour laquelle la séparation de charge est minimale.
Aide à la lecture
On demande d'écrire les structures de Lewis possibles de l'ion énolate, du cation nitrosyle et du monoxyde de carbone. Parmi les structures obtenues, on indiquera celles qui sont les plus contributives à l'aide des trois critères relatifs aux structures de résonance.
Solution détaillée
1. Dans le cas l'ion énolate, le premier critère ne permettant pas de trancher sur l'importance des deux structures (chaque atome possède son octet d'électrons), nous devons utiliser le deuxième critère. La structure de résonance la plus contributive est la structure \(\textrm A\). En effet, pour cette structure, la charge négative est portée par l'atome d'oxygène plus électronégatif que le carbone.

2. Deux structures de résonance sont envisageables pour le monoxyde de carbone. La structure \(\textrm A\) fait apparaître un sextet d'électron sur le carbone et un octet sur l'oxygène. La structure \(\textrm B\) fait apparaître un octet d'électrons à la fois sur l'atome d'oxygène et sur l'atome de carbone. La structure de Lewis la plus contributive est donc la structure \(\textrm B\) (critère 1). Dans le cas présent, malgré le fait que les structures neutres soient en générales plus contributives que les structures chargées, le critère 1 prend la préséance sur le critère 3.
Deux structures de résonance sont aussi envisageables pour l'ion nitrosyle. La structure de Lewis la plus contributive est la structure \(\textrm A\) car elle fait apparaître un octet d'électrons sur l'atome d'oxygène et l'atome d'azote (critère 1). Dans le cas présent, le critère 1 prend la préséance sur le critère 2.