Structure de résonance et réactivité
Partie
Question
On considère la molécule aromatique d'imidazole. Une des formules de Lewis est donnée ci-dessous :
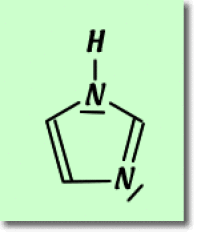
Déterminez le nombre d'électrons \(\pi\) fournis par chaque atome du cycle. Indiquez l'état d'hybridation de chaque atome composant le cycle.
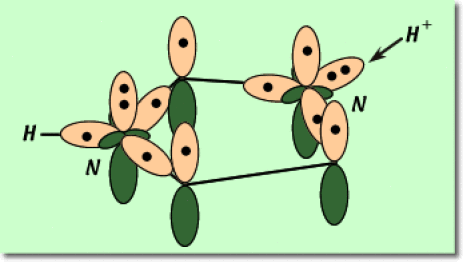
Représentez la forme mésomère « orbitalaire » \(\pi\) de cette molécule, correspondant au schéma de Lewis donné ci-dessus. Le dessin devra être clair et soigné. Représentez aussi les électrons présents dans les orbitales.
Quel est l'atome d'azote le plus basique ? Justifiez votre réponse.
Aide simple
Une molécule aromatique est une molécule cyclique, conjuguée, possédant \(4\mathrm{n}+2\) électrons \(\pi\). La conjugaison apporte un surcroît de stabilité. Elle peut alors conduire à s'affranchir des règles « classiques » de Gillespie.
Aide méthodologique
1. La règle d'aromaticité permet de déduire le nombre d'électrons \(\pi\). Pour chaque atome, on examine le type VSEPR (règles de Gillespie), tout en veillant à retrouver le nombre total d'électrons \(\pi\).
3. On se réfère ici au caractère basique de Lewis. Il s'agit d'identifier l'atome le plus apte à capturer un proton par liaison dative mettant en jeu une paire non liante.
Aide à la lecture
On demande de déterminer le nombre d'électrons \(\pi\) engagés dans ce cycle aromatique. On détermine alors l'hybridation des orbitales atomiques de chaque atome constituant le cycle imidazole (3 atomes de carbone et 2 atomes d'azote).
On demande de représenter schématiquement le cycle imidazole et pour des raisons de clarté, uniquement les orbitales atomiques qui sont impliquées dans le système \(\pi\). Ces orbitales sont représentées sous une forme qualitative et contiennent les électrons \(\pi\).
Parmi les deux azote présents sur le cycle, on demande de déterminer quel est l'azote dont le plus apte à capter un proton.
Solution détaillée
1. Le caractère aromatique du cycle conduit à considérer que non seulement les deux doubles liaisons participent au système \(\pi\), mais aussi une des paires non liantes des azotes, pour fournir 2n + 2 = 6 électrons au système \(\pi\).
Dans le cas des atomes de carbone, le type VSEPR est \(\textrm{AX}_3\) : l'hybridation est de type \(\textrm{sp}^2\). Chaque atome de carbone fournit un électron \(\pi\).
Dans le cas de l'azote 3, le type VSEPR est \(\textrm{AX}_2\textrm E\) : il est aussi hybridé \(\textrm{sp}^2\) et la paire non liante est portée par une des orbitales hybrides.
Elle ne participe donc pas à la conjugaison.
Dans le cas de l'azote 1, la paire libre doit donc participer à la conjugaison. Elle est alors portée par une orbitale \(2p\) perpendiculaire au plan du cycle. L'hybridation est donc de type \(\textrm{sp}^2\) et ne suit pas la règle VSEPR habituelle.
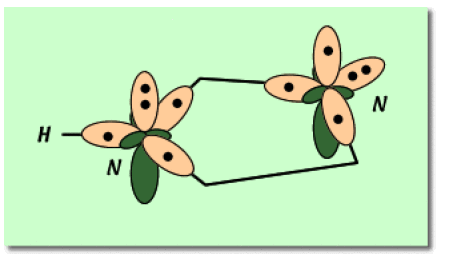
Remarque : L'hybridation \(\textrm{sp}^2\) permet de mettre en jeu plus de liaisons covalentes dans la résonance. Elle stabilise alors mieux le nuage électronique. Elle l'emporte donc et il faut considérer que les deux atomes d'azote sont hybridés \(\textrm{sp}^2\).
2. La représentation graphique des orbitales impliquées dans des liaisons de type \(\pi\) se résume aux orbitales \(2p_\pi\) . On y place les électrons \(\pi\), représentés par des points noirs.
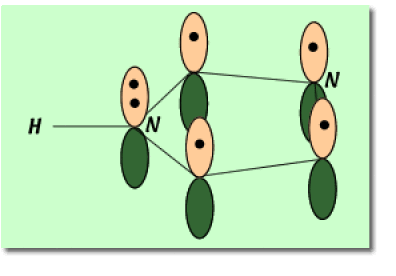
3. L'atome d'azote le plus basique est celui qui n'est pas lié à un hydrogène. Son doublet d'électrons non-liants n'étant pas impliqué dans l'aromaticité du cycle est plus apte à capturer un proton. L'atome d'azote 3 est donc le plus basique.