Quelle forme ont les orbitales d ?
Comme pour les orbitales \(\textrm p\), la forme des orbitales \(\textrm d\) est loin d'être de symétrie sphérique. Elle est déterminée par la géométrie du cortège électronique. Les orbitales \(\textrm d\) sont au nombre de cinq : \(\textrm d_{\textrm{xy}}\), \(\textrm d_{\textrm{xz}}\), \(\textrm d_{\textrm{yz}}\), \(\textrm d_{\textrm x^2-\textrm y^2}\) et \(\textrm d_{z^2}\). Ce sont des orbitales directionnelles formées de quatre lobes excepté l'orbitale \(\textrm d_{z^2}\).
Les orbitales \(\textrm d_{\textrm{xy}}\), \(\textrm d_{\textrm{xz}}\) et \(\textrm d_{\textrm{yz}}\) ont même symétrie (lobes centrés sur les bissectrices des axes).
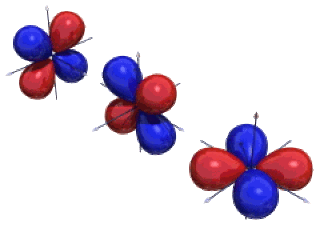
Figure 1. Représentation des surfaces d'isodensité des orbitales 3dxy, 3dxz et 3dyz

Figure 2. Représentation des surfaces d'isodensité de l'orbitale 3dx2-y2
Les orbitales \(\textrm d_{\textrm x^2-\textrm y^2}\) et \(\textrm d_{\textrm z^2}\) ont leurs lobes centrés sur les axes \(\textrm O_\textrm x\), \(\textrm O_\textrm y\), \(\textrm O_\textrm z\).
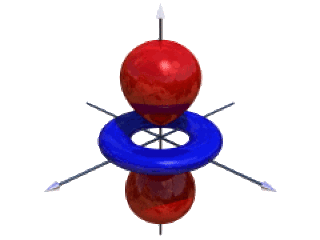
Les cinq orbitales \(\textrm d\) d'un élément chimique ont la même énergie. On dit qu'elles sont dégénérées.