Mesure expérimentale : les métaux de transition ont-ils des couleurs ?
Les complexes de métaux de transition sont souvent colorés. Leur couleur est une conséquence de la séparation énergétique des orbitales \(\textrm e_\textrm g\) et \(\textrm t_{2\textrm g}\) .
Prenons le cas le plus simple d'un ion de transition avec un seul électron \(\textrm d\) (\(\textrm d^1\)) dans un environnement octaédrique.
La figure ci-dessous donne le diagramme d'énergie des orbitales \(\textrm d\) (en symétrie octaédrique).
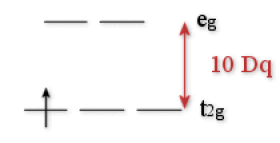
Ce diagramme se résume à deux niveaux d'énergie (celui du groupe d'orbitales \(\textrm t_{2\textrm g}\) . et celui du groupe d'orbitales \(\textrm e_\textrm g\)).
Si ce complexe reçoit un photon d'énergie \(\textrm h\nu\) telle que \(\textrm h\nu = 10\textrm{ Dq}\), l'électron peut passer de \(\textrm t_{2\textrm g}\) en \(\textrm e_\textrm g\) . Il y a absorption de la radiation correspondante. Si cette radiation est située dans le spectre visible, le complexe est coloré. La position de la radiation absorbée permet la détermination expérimentale de 10 Dq (énergie du champ cristallin ou différence d'énergie entre les groupes d'orbitales \(\textrm e_\textrm g\) et \(\textrm t_{2\textrm g}\) ).