Propriétés des complexes octaédriques des métaux de transition
Durée : 8 mn
Note maximale : 10
Question
On considère les complexes octaédriques ayant six ligands identiques.
1. Donner la répartition des électrons sur les orbitales \(d\) pour les atomes ayant 1, 2, 3, ..., 10 électrons pour les cas d'une configuration à champ fort et à champ faible.
2. Quels sont les cas où l'on ne fait pas la différence entre les configurations à champ fort et à champ faible ?
3. Quels sont les cas les plus stables et ceux où les ligands n'apportent pas de stabilité supplémentaire ?
Solution
1. On se sert du diagramme d'énergie suivant et on place successivement les électrons :
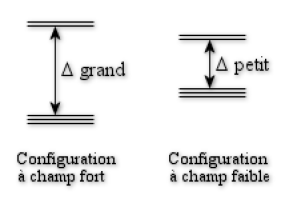
Nombre d'électrons \(d\) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Configuration à champ fort | \({\textrm t_{2g}}^1\) | \({\textrm t_{2g}}^2\) | \({\textrm t_{2g}}^3\) | \({\textrm t_{2g}}^4\) | \({\textrm t_{2g}}^5\) | \({\textrm t_{2g}}^6\) | \({\textrm t_{2g}}^6{\textrm e_{g}}^1\) | \({\textrm t_{2g}}^6{\textrm e_{g}}^2\) | \({\textrm t_{2g}}^6{\textrm e_{g}}^3\) | \({\textrm t_{2g}}^6{\textrm e_{g}}^4\) |
Configuration à champ faible | \({\textrm t_{2g}}^1\) | \({\textrm t_{2g}}^2\) | \({\textrm t_{2g}}^3\) | \({\textrm t_{2g}}^3{\textrm e_{g}}^1\) | \({\textrm t_{2g}}^3{\textrm e_{g}}^2\) | \({\textrm t_{2g}}^4{\textrm e_{g}}^2\) | \({\textrm t_{2g}}^5{\textrm e_{g}}^2\) | \({\textrm t_{2g}}^6{\textrm e_{g}}^2\) | \({\textrm t_{2g}}^6{\textrm e_{g}}^3\) | \({\textrm t_{2g}}^6{\textrm e_{g}}^4\) |
Barème : 2 points.
2. Les cas ayant 1, 2, 3, 8, 9 et 10 électrons sont les mêmes.
Barème : 1 point par cas.
3. La stabilité se calcule à partir des écarts \(+\frac{3}{5}\Delta\)(soit +6\(\textrm{Dq}\)) et \(-\frac{2}{5}\Delta\)(soit -4\(\textrm{Dq}\)), et du nombre d'électrons sur chaque niveau.
Le cas le plus stable est celui correspond à la configuration à spin fort et 6 électrons.
Il n'y a pas de stabilité supplémentaire pour une configuration à champ faible avec 5 ou 10 électrons, et pour une configuration à champ fort avec 10 électrons.
Barème : 2 points.