1ère approche :
Transitions d-d et interprétation qualitative des spectres
La couleur des complexes résulte de transitions intraconfigurationnelles entre orbitales \(\textrm d\). En effet, la différence d'énergie entre orbitales \(\textrm t_{2\textrm g}\)et \(\textrm e_\textrm g\) égale à \(\Delta\) varie entre 10 000 cm-1 et 20 000 cm-1, c'est-à-dire une gamme d'énergie correspondant au spectre visible du rayonnement électromagnétique (figure ci-dessous, \(800\textrm{ nm} > \lambda > 400\textrm{ nm}\)). Une transition électronique correspond au passage d'un électron du niveau fondamental vers un niveau excité. Lorsqu'elle a lieu, la matière absorbe un photon dont l'énergie correspond rigoureusement à la différence d'énergie entre le terme fondamental et un terme excité. Elle suit également des règles de sélection : l'une liée au moment orbital et l'autre lié au moment de spin. Une transition autorisée a lieu si les orbitales impliquées au cours de ce processus sont telles que \(\Delta \textrm l = \textrm{}^+_-1\) et si \(\Delta \textrm S = 0\). En d'autres termes, le photon fait changer la symétrie de l'orbitale occupée par l'électron avant et après la transition mais en aucun cas le spin de cet électron.
Les transitions \(\textrm{d-d}\) sont interdites selon la première règle car \(\Delta \textrm l = 0\), mais elles sont observées grâce à des mécanismes de relaxation liés essentiellement à des couplages électrons-noyaux (rôle des vibrations). Par contre une transition \(\textrm{d-d}\) avec changement de spin est interdite selon les deux règles. Là encore, elle peut être observée grâce à des mécanismes de relaxation beaucoup moins efficaces liés aux couplages entre moments de spin et moments orbitaux des électrons. Par conséquent, ces transitions sont beaucoup moins intenses que les transitions \(\textrm{d-d}\) permises de spin. Nous ne parlerons que des transitions permises de spin dans la suite.
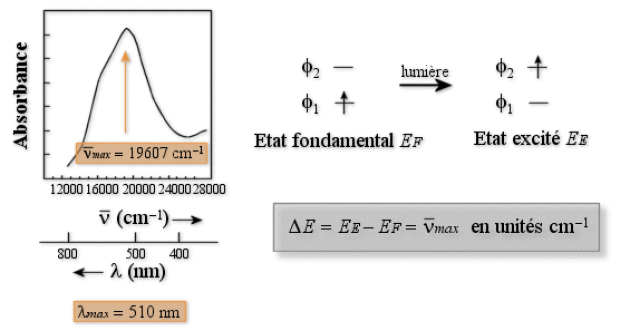
Un spectre électronique (mesure de la variation de l'absorbance d'une solution en fonction de \(\lambda\), voir figure ci-dessous) peut être formé d'une ou plusieurs transitions électroniques.
Si un complexe ne présente qu'une seule transition, la couleur de ce complexe correspond à la couleur complémentaire de la couleur absorbée pendant la transition (figure ci-dessous).

Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Spectres à une bande : interprétation de la couleur des complexes
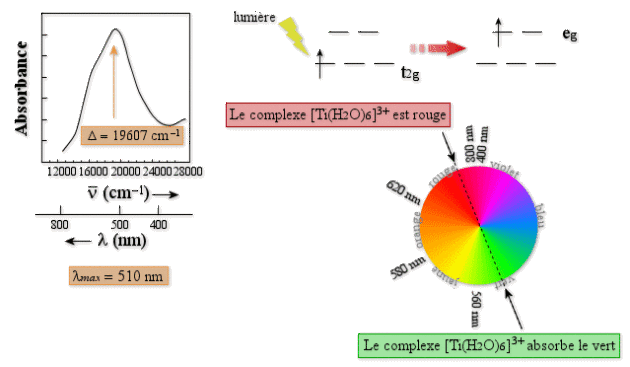
Cette situation se produit dans les complexes des ions \(\textrm{Ti}^{3+}\) de configuration \(\textrm d^1\). Une solution aqueuse de \([\textrm{Ti}(\textrm H_2\textrm O_2)_6]^{3+}\) est rouge. Le spectre d'absorption (figure ci-dessous) est formé d'une seule bande avec \(\lambda_{max} = 510\textrm{ nm}\). La couleur absorbée est le vert, le complexe apparaît de la couleur complémentaire : le rouge. La bande observée est interprétée comme la transition de l'électron de l'orbitale \(\textrm t_{2\textrm g}\) vers l'orbitale \(\textrm e_\textrm g\). L'énergie de cette transition est égale à \(\Delta\). On obtient donc la valeur de \(\Delta\) à 510 nm, soit en unités cm-1, 19 607 cm-1.
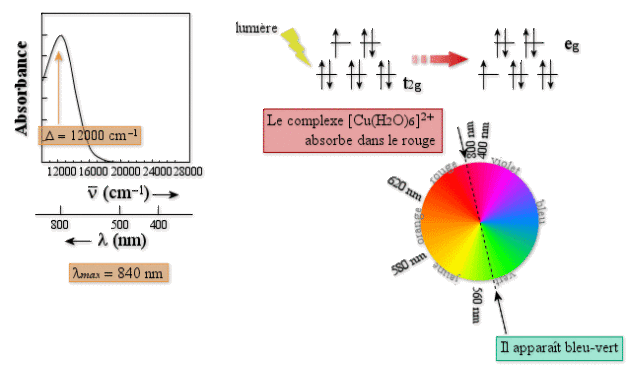
Un cas similaire est celui de l'ion hexaaquo de cuivre (II) : \([\textrm{Cu}(\textrm H_2\textrm O_2)_6]^{2+}\) de configuration \(\textrm d^9\). Dans ce cas, le composé est bleu-vert, et son spectre est constitué d'une seule bande située à 840 nm. Il absorbe le rouge, et apparaît donc de la couleur complémentaire. Le spectre s'analyse de façon semblable (figure ci-dessous). On peut voir cette transition comme le passage de l'électron d'une orbitale \(\textrm t_{2\textrm g}\) à une orbitale \(\textrm e_\textrm g\). La transition possède toujours l'énergie \(\Delta\). Dans ce cas, \(\Delta\) vaut 12 000 cm-1.
De l'analyse de ces deux spectres, on donne une preuve expérimentale que le champ cristallin augmente avec la charge de l'ion de transition. De manière générale, \(\Delta_{\textrm M^{3+}} > \Delta_{\textrm M^{2+}}\).
Spectre à deux bandes : rôle de la répulsion « électron-électron »
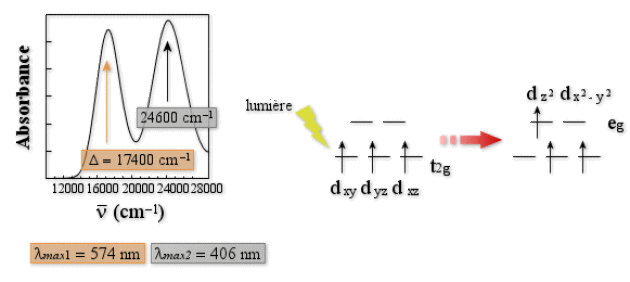
Examinons maintenant le spectre visible du complexe \([\textrm{Cr}(\textrm H_2 \textrm O)_6]^{3+}\) dont la configuration de plus basse énergie est \(\textrm t_{2\textrm g}^3\). Celui-ci est formé de deux bandes d'intensité semblable à 17 400 cm-1 et 24 600 cm-1 (figure ci-dessous), dont l'origine est à chercher dans des transitions \(\textrm t_{2\textrm g}\to \textrm e_\textrm g\). Une façon de réaliser cette transition est de promouvoir l'électron de l'orbitale \(\textrm d_{\textrm{xy}}\) vers l'orbitale \(\textrm d_{\textrm z^2}\) (figure suivante). Dans ce cas, la densité électronique est relocalisée au cours de la transition d'un plan \(\textrm{xy}\) dans une direction \(\textrm z\) déjà riche en électron (les orbitales \(\textrm d_{\textrm{xz}}\) et \(\textrm d_{\textrm{yz}}\) sont occupées). Mais il existe une autre façon de réaliser cette transition en faisant passer l'électron de l'orbitale \(\textrm d_{\textrm{xz}}\) vers l'orbitale \(\textrm d_{\textrm z^2}\). Dans ce cas, la densité électronique sera simplement relocalisée selon un axe \(z\) déjà riche en électron avant la transition. On conçoit aisément que pour le premier cas la répulsion électronique va beaucoup augmenter au cours de la transition, et beaucoup moins dans le second cas. Par conséquent les deux transitions envisagées apparaissent à des énergies différentes. Les autres possibilités de transitions \(\textrm t_{2\textrm g}\to \textrm e_\textrm g\) seront similaires à l'un ou l'autre cas, si bien que le complexe possède deux bandes dans son spectre d'absorption.

Remarque :
Les flèches grises indiquent la relocalisation de la densité électronique au cours des deux transitions étudiées dans le texte
La figure ci-dessus montre les déplacements de la densité électronique accompagnant les deux transitions étudiées. En (I), la densité électronique se déplace fortement vers les ligands sur l'axe \(\textrm z\). Alors qu'en (II), le déplacement est beaucoup plus faible.
Une question vient à l'esprit immédiatement, quelle transition va permettre de déterminer \(\Delta\)? Intuitivement, on choisira la transition de plus basse énergie, et on aura raison. On détermine donc \(\Delta = 17400 \textrm{ cm}^{-1}\).