Préparation
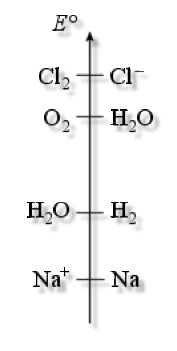
On extrait principalement le dichlore par électrolyse de solutions salines (\(\textrm{NaCl}\)). L'électrolyse met en jeu des compétitions entre les couples du solvant (\(\textrm H_2\textrm O\)) et des ions provenant de la dissolution de \(\textrm{NaCl}\), \(\textrm{Na}^+\) et \(\textrm{Cl}^-\):
solvant :
\(\textrm H_2\textrm O\textrm{/H}_2\textrm{ }\textrm{ }E°=0 \textrm V\textrm{ }\textrm{(à pH=0),}\textrm{ }\textrm{ }E°^{*}=0 \textrm,42 \textrm V\textrm{ }\textrm{(à pH=7)}\)
\(\textrm O_2\textrm{/H}_2\textrm O\textrm{ }\textrm{ }E°=1\textrm,23 \textrm V\textrm{ }\textrm{(à pH=0),}\textrm{ }\textrm{ }E°^*=0 \textrm,81 \textrm V\textrm{ }\textrm{(à pH=7)}\)
ions :
\(\textrm{Na}^+\textrm{/Na}\textrm{ }\textrm{ }E°=-2\textrm,70 \textrm V\)
\(\textrm{Cl}_2\textrm{/Cl}^-\textrm{ }\textrm{ }E°=1\textrm,40 \textrm V\)
\(E°\) : potentiel standard de référence (à pH=0, et par rapport à l'électrode normalisée à hydrogène).
\(E°^*\) : potentiel redox standard apparent (à un pH donné).
Définition : Le potentiel redox standard apparent
Le potentiel redox standard apparent est le potentiel standard (pression 1 atm, température \(298 \textrm K\), \(\textrm{pH}=0\)) corrigé de l'effet de \(\textrm{pH}\). Ainsi le potentiel standard du couple \(\textrm O_2\textrm{/H}_2\textrm O\) est \(E°=1\textrm,23 \textrm V\) et le potentiel apparent standard pour tout \(\textrm{pH}\) est \(E°^*=1\textrm,23-0\textrm,06 \textrm{pH}\) . On trouve bien le couple \(\textrm O_2\textrm{/H}_2\textrm O\) à \(\textrm{pH}=7\) \(E°^*=0\textrm,81 \textrm V\) (vous trouverez des exemples de détermination de cette relation entre \(E°\) et \(E°^*\) dans la partie de ce cours qui décrit la construction du diagramme de Pourbaix du chlore).
Ainsi, théoriquement, l'électrolyse du solvant devrait commencer avant celle du sel.
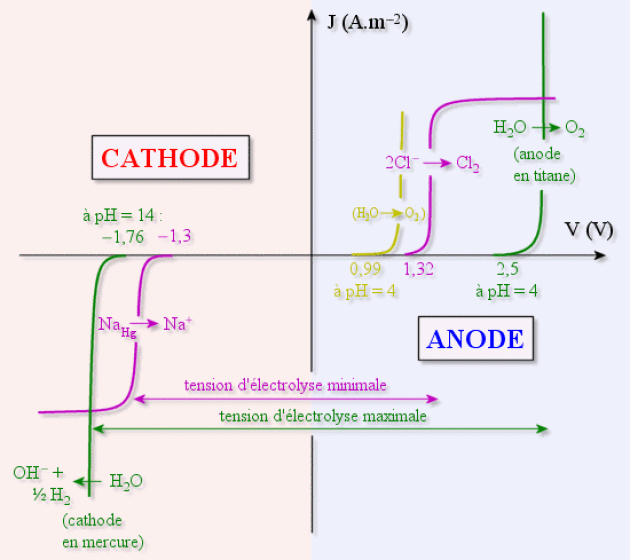
Mais, en considérant les effets de surtension dus à la nature de l'anode, il est possible d'éviter l'électrolyse de l'eau en choisissant les bonnes électrodes. Ainsi les courbes intensité - potentiel pour différentes anodes et cathodes données ci-dessous permettent de comprendre les réactions mises en jeu suivant l'installation utilisée.
La majorité des installations industrielles en Europe utilisait des installations avec anode au titane et cathode au mercure, ce qui permettait, comme on le voit sur le diagramme ci-dessous, d'éviter complètement l'électrolyse de l'eau. L'intérêt pour l'industriel était de récupérer, à partir de l'amalgame \(\textrm{Na(Hg)}\), du sodium sans impureté pour fabriquer de la soude de très bonne qualité :
\(2.\textrm{Na(Hg)}+2.\textrm H_2\textrm O\to 2.\textrm{(Na}^+\textrm{,OH}^-\textrm)+\stackrel{\uparrow}{\textrm H_2}+\textrm{Hg (l)}\)
Le mercure est réutilisé comme cathode.
La législation européenne a décidé l'arrêt des usines de ce type afin de stopper la pollution au mercure, inévitable malgré le haut rendement du recyclage du mercure.
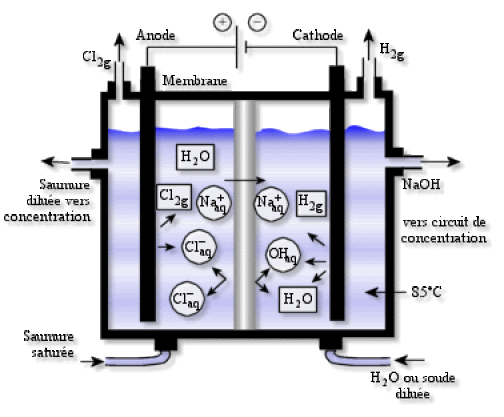
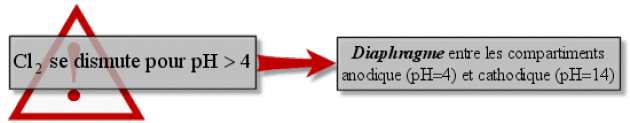
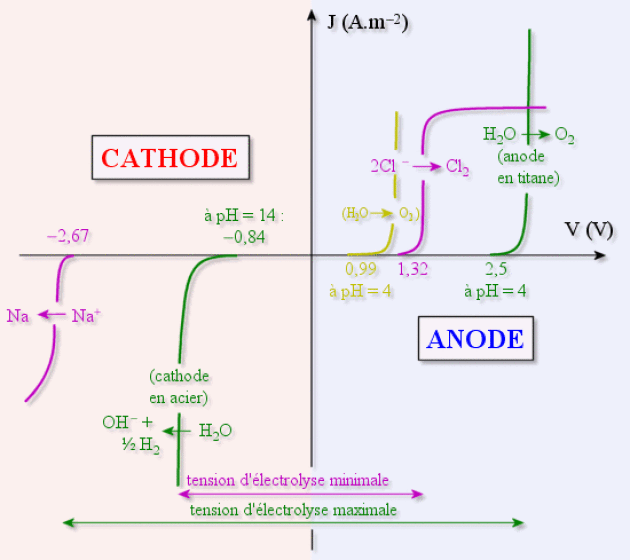
Les systèmes qui sont et seront utilisés majoritairement utilisent une cathode en acier dans une enceinte séparée de celle qui contient l'anode par une membrane polymère sélective afin de récupérer les ions \(\textrm{Na}^+\) sans présence de \(\textrm{Cl}^-\) et ainsi fabriquer de la soude de bonne pureté.
On observe donc d'après le diagramme les réactions suivantes :
à l'annode en titane : \(2.\textrm{Cl}^-\textrm{ (aq)}\to\textrm{Cl}_2\textrm{ (g)}+2.\textrm e^-\)
à la cathode en acier : \(2.\textrm H_2\textrm{O (l)}+2.\textrm e^-\to2.\textrm{OH}^-\textrm{ (aq)}+\textrm H_2\textrm{ (g)}\)