Autres dérivés monosubstitués du cyclohexane
La différence d'énergie libre entre le conformère axial a et l'équatorial e rend compte de leur stabilité relative.
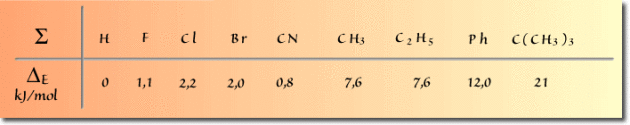
\(\mathbf{\Delta E=G_a-G_e}\)
Elle dépend de la nature du substituant.
Deux facteurs interviennent simultanément : non seulement le rayon de van der Waals \(R\) du substituant, mais aussi la longueur d de la liaison entre le substituant et le carbone du cycle.
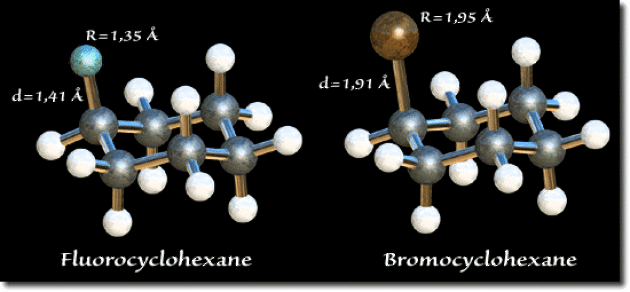
Si l'on considère par exemple les substituants \(\textrm F\) et \(\textrm{Br}\) la valeur du \(\Delta E\) est du même ordre de grandeur. Le rayon de van der Waals plus important du brome est compensé par une longueur de liaison \(\textrm C-\textrm{Br}\) plus grande. Dans l'illustration ci-dessous, les substituants halogènes sont en position axiale (conformation la moins stable).
En revanche, lorsque la longueur de la liaison carbone-substituant ne varie pas, plus le substituant en position axiale est volumineux, plus les interactions avec les hydrogènes axiaux sont importantes ; c'est par exemple le cas des substituants \(\textrm{CH}_3\) et \(\textrm{CMe}_3\). Dans l'illustration ci-dessous on a placé les substituants en position axiale. Pour le substituant tert-butyle, l'interaction répulsive, symbolisée par un flash lumineux, est très importante. La position équatoriale est donc largement privilégiée.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.