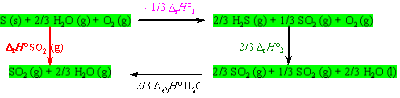Question
Énoncé
Déterminer et exprimer en kJ.mol-1, l'enthalpie molaire standard de formation du dioxyde de soufre SO2 gazeux.
Données :
Enthalpies molaires standard de réactions
(1) 2 H2S (g) + SO2 (g) = 3 S (s) + 2 H2O (g)\( \Delta_rH_1°\) = - 143,3 kJ.mol-1
(2) H2S (g) + 3/2 O2 (g) = SO2 (g) + H2O (l) \(\Delta_rH_2°\) = - 560,5 kJ.mol-1
Enthalpie molaire standard d'ébullition de l'eau : \(\Delta_{\textrm{éb}}H°\) = 44,3 kJ.mol-1.
Aide simple :
Il est nécessaire d'écrire un cycle de Hess (ou une combinaison de réactions) de façon à retrouver, à partir d'autres réactions, le processus dont on veut déterminer l'enthalpie molaire standard.
Rappel de cours :
Le soufre S (s) apparaît uniquement dans l'équation de la réaction (1) où il est l'un des produits ! Si l'on souhaite faire apparaître ce corps simple en tant que réactif, on devra donc utiliser cette équation de réaction, mais il faudra l'écrire dans l'autre sens, en inversant les rôles des réactifs et des produits.
De plus, si l'on veut que le coefficient stœchiométrique de ce réactif soit égal à - 1, il faudra diviser par 3 les coefficients stoechiométriques de (1).
Résultat
Correction
Explications
Le diagramme de Hess fait apparaître 4 états du système (voir cadres verts ci-dessous).
Comme l'enthalpie est une fonction d'état, il vient :
\(\Delta_f H°_{SO_2} (g) = - \frac{1}{3} \Delta_rH_1° + \frac{2}{3} \Delta_rH_2° + \frac{2}{3} \Delta_{\textrm{éb}}H°_{H_2O} = (- \frac{1}{3} \times - 143,3) + (\frac{2}{3} \times - 560,5) + (\frac{2}{3} \times 44,3)\) = - 296,4 kJ.mol-1.
On peut également écrire une combinaison linéaire des équations des réactions fournies de façon à retrouver, en les additionnant, la réaction de formation :
\(\frac{\begin{array}{c c c c c c c c } S(s)&+& 2/3H_2O&=&2/3H_2S (g)&+& 1/3 SO_2 (g)&- 1/3 \Delta_rH_1° \\ 2/3H_2S(g)&+&O_2 (g)&=& 2/3SO_2(g)&+&2/3H_2O& 2/3 \Delta_rH_2° \\ &&2/3H_2O(l)&=& 2/3H_2O(g)&&& 2/3 \Delta_{\textrm{éb}}H°_{H_2O}\end{array}}{\begin{array}{c c c c c c c c} S(s)&+&O_2(g)&=&SO_2(g)&&&\Delta_f H°_{SO_2, g} \\ \end{array}}\)
En sommant les enthalpies des étapes nécessaires, on retrouve la formule établie avec le cycle de Hess.