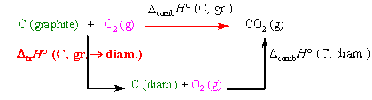Question
Énoncé
Déterminer et exprimer, en kJ.mol-1, l'enthalpie molaire standard à 298 K de la transition : C (graphite) = C (diamant).
Données :
Enthalpie molaire standard de combustion du diamant à 298 K : - 395,4 kJ.mol-1
Enthalpie molaire standard de combustion du graphite à 298 K : - 393,5 kJ.mol-1
Aide simple :
Il est intéressant d'écrire un cycle de Hess montrant :
le processus dont on veut déterminer l'enthalpie molaire standard ;
les réactions de combustion du diamant et du graphite.
Rappel de cours :
L'équation d'une réaction de combustion s'écrit en affectant la valeur - 1 au coefficient stœchiométrique de l'espèce "carburant".
L'écriture de l'équation d'une réaction de formation fait intervenir les réactifs sous la forme de corps simples dans l'état standard.
L'unique produit de la réaction est le composé formé. Son coefficient stœchiométrique est égal à 1.
Résultat
Correction
Explications
Diagramme de Hess :
Comme l'enthalpie H est une fonction d'état, il vient :\( \Delta_{tr}H°(C ; graphite \rightarrow diam) = \Delta_{comb}H°(graphite) - \Delta_{comb}H°(diamant)\) = -393,5 - (-395,4) = 1,9 kJ.mol-1.
La combinaison linéaire des équations des réactions et des enthalpies mises en jeu conduit au même résultat :
\(\frac{\begin{array}{c c c c c c c c} C (graphite)&+& O_2 (g)&=& CO_2 (g)&&& \Delta_{comb}H°(graphite) \\ &&CO_2 (g)&=& C (diamant)&+&O_2 (g)& -\Delta_{comb}H°(diamant) \end{array}}{\begin{array}{c c c c c c c c} &&C (graphite)&=&C (diamant)&&&\Delta_{tr}H°(graph \rightarrow diam.) \\ \end{array}}\)