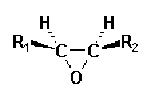Les intermédiaires réactionnels
Nous avons vu que dans une réaction élémentaire on peut considérer que le passage des réactifs aux produits se fait selon une transformation continue, l'énergie du système varie au cours du processus de transformation et passe par un maximum qui correspond à un état transitoire appelé complexe activé ou état de transition. C'est par exemple le cas de la réaction de substitution nucléophile SN2.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Dans une réaction complexe, constituée de plusieurs processus élémentaires, interviennent des espèces chimiques qui ne figurent pas dans l'équation bilan.
On doit faire une distinction entre les complexes activés (qui sont des structures d'énergie élevée et dont la durée de vie est extrêmement brève) et de véritables intermédiaires réactionnels qui, bien qu'ayant une durée de vie relativement brève, peuvent parfois être mis en évidence par des méthodes physiques ou chimiques. Ces intermédiaires correspondent à des minimums d'énergie le long du chemin réactionnel.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
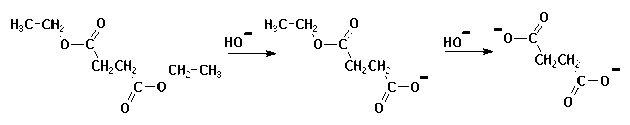
Dans d'autres réactions, c'est la seconde étape qui est plus lente que la première.
Par exemple dans le cas de l'hydrolyse basique d'un diester.
Le profil énergétique est différent :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Les intermédiaires réactionnels peuvent être des molécules neutres, des ions ou des radicaux.
Intermédiaires moléculaires
Certaines molécules sont instables dans les conditions où elles se sont formées. Dès lors elles n'apparaîtront pas dans le bilan de la réaction. Par exemple, l'hydrolyse des acétals des benzaldehydes dont l'équation bilan est :
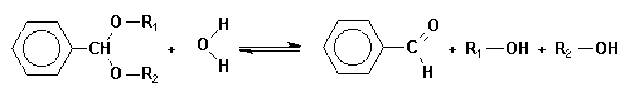
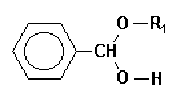
Cette réaction se produit en deux étapes, la première conduisant à un hémiacétal intermédiaire :
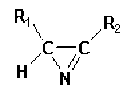
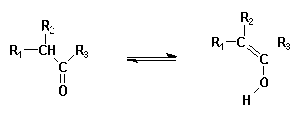
Des structures ou formes moléculaires inusuelles sont souvent proposées comme intermédiaires ; l'existence de certaines d'entre elles a pu être établie expérimentalement, d'autres restent hypothétiques.
Exemple :
Intermédiaires ioniques
En phase gazeuse, les ions peuvent être obtenus par des décharges électriques, bombardement électronique ou des rayonnements ionisants. Ce sont des espèces très réactives de faible durée de vie, mais qui peuvent néanmoins être étudiées en spectrométrie de masse.
Au cours des orages les décharges électriques intenses produisent des quantités importantes d'ions négatifs et la formation d'ozone.
L'azote de l'air particulièrement inerte, se combine avec l'oxygène sous l'effet des éclairs, les oxydes d'azote formés sont entraînés dans les sols par la pluie.

En solution, les ions sont stabilisés par la solvatation.
En chimie organique, les carbocations et les carbanions constituent des intermédiaires réactionnels très importants.
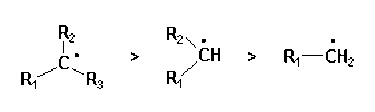
L'ordre de stabilité décroissante des carbocations est la suivante :
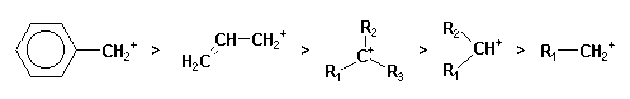
benzylique > allylique > aliphatique tertiaire > aliphatique secondaire > aliphatique primaire.
Le carbone porteur de la charge positive est hybridé en \(\textrm{sp}^2\), ce qui permet la conjugaison avec les systèmes \(\pi\) en alpha.
Certains carbocations sont spécialement stables.
C'est le cas par exemple des cations benzyliques porteurs d'un groupement donneur en para :
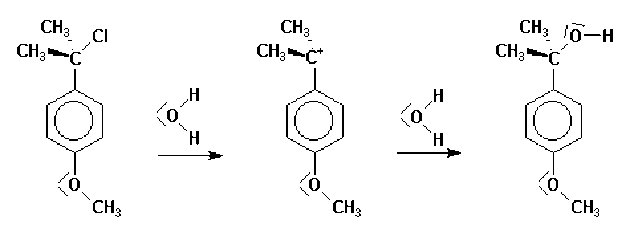
La séquence de stabilité observée en série alkyle s'explique par l'effet donneur des groupes alkyles qui tend à répartir la charge sur plusieurs atomes.
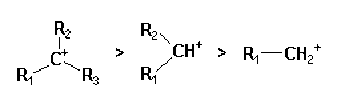
Les carbanions se forment notamment par rupture hétérolytique d'une liaison \(\textrm C-\textrm H\) sous l'effet d'une base.

D'autres modes de formation des carbanions existent également. Par exemple avec les organo métalliques.
La discussion de la stabilité relative des carbanions est plus délicate pour les carbocations.
Les carbanions dont la charge peut être délocalisée sont les plus stables. La présence en alpha d'une double liaison carbone-oxygène ou carbone-azote stabilise encore plus fortement le carbanion. En série alkyle, l'ordre de stabilité est l'inverse de celle des carbocations. Cette question est encore controversée.
Les intermédiaires radicalaires
Les radicaux se forment par rupture homolytique d'une liaison covalente.
Les atomes libres radicalaires sont des espèces très réactives de durée de vie de l'ordre de 10-2 s ; électriquement neutres, ils se manifestent par leurs propriétés paramagnétiques et peuvent être détectés par RPE (résonance paramagnétique électronique). Ces espèces interviennent surtout en phase gazeuse.
Exemple : hydrogène, brome, atomique.
Ainsi l'atome de brome se forme par photolyse de la molécule de brome.
\(\mathbf{\textrm{Br}_2\to2.\textrm{Br}^\bullet}\)
Réaction qui se produit par absorption de rayonnements.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Avec les notations de Lewis la réaction s'écrit :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
L'oxygène atomique constitue un cas particulier puisqu'il comporte deux électrons avec des spins non appariés. L'oxygène atomique joue un rôle important dans la chimie de la haute atmosphère et participe à l'ensemble complexe de réactions qui concourent à la décomposition de l'ozone.
Un des processus élémentaires de cet ensemble de réactions est la dissociation unimoléculaire de l'ozone excité suivant
\(\mathbf{\textrm O_3 \to \textrm O_2 + \textrm O^\bullet}\)
Les réactions dans la haute atmosphère sous l'effet de rayonnements ionisants produisent, entre autres, des atomes d'oxygène excités qui émettent des lueurs de couleur pourpre, verte ou bleu qui donnent lieu à des phénomènes colorés tels que les aurores boréales.
Photo offerte par Michel Lambert et le Laboratoire de Planétologie de Grenoble.

Des radicaux libres diatomiques ont été mis en évidence dans le cas de réactions hautement énergétiques : flammes, explosions. Leur durée de vie est encore plus brève 10-4 à 10-3 s.
Exemples : \(\textrm C_2^\bullet\), \(\textrm{CH}^\bullet\), \(\textrm{CN}^\bullet\), \(\textrm{NH}^\bullet\), \(\textrm{OH}^\bullet\) , etc.
Le radical hydroxyle intervient dans les réactions de combustions ou d'explosions.
Les réactions qui ont lieu à l'intérieur des flammes sont des réactions radicalaires en chaînes. Leur initiation demande de l'énergie, mais une fois déclenchée, elles se propagent rapidement.
Les réactions de combustion dans les moteurs à explosion sont également des réactions radicalaires.

Quelques radicaux triatomiques comme \(\textrm{CHO}^\bullet\), \(\textrm{NH}_2^\bullet\), \(\textrm N_3^\bullet\) ont également été détectés.
Les radicaux libres organiques lourds sont invoqués dans de nombreuses réactions.
Exemple : La décomposition thermique du diméthyl peroxyde
\(\mathbf{2.\textrm{CH}_3\textrm{OOCH}_3 = 3.\textrm{CH}_3\textrm{OH} + \textrm{CO}}\)
se fait par une suite complexe de réactions en chaîne dont la première étape est la formation du radical \(\textrm{CH}_3\textrm O^\bullet\) par rupture homolytique de la liaison \(\textrm O-\textrm O\)
\(\mathbf{\textrm{CH}_3\textrm{OOCH}_3 \to 2.\textrm{CH}_3\textrm O^\bullet}\)
Exemple :
Le radical méthyle peut être obtenu par décomposition thermique du plomb tétraméthyle \(\textrm{Pb}(\textrm{CH}_3)_4\)
\(\mathbf{\textrm{Pb}(\textrm{CH}_3)_4 \to \textrm{Pb} + 4.\textrm{CH}_3^\bullet}\)
Cette réaction présente un intérêt historique, car elle a permis de démontrer l'existence de radicaux organiques en 1929 (expérience dite des miroirs de Paneth)
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Les radicaux organiques peuvent être stabilisés par délocalisation de l'électron radicalaire. En particulier les radicaux aryliques et allyliques sont considérablement plus stables que les radicaux aliphatiques. Ainsi, le radical benzyle est beaucoup plus stable que le radical méthyle ainsi que le montre la réaction rapide du radical méthyle avec le toluène.
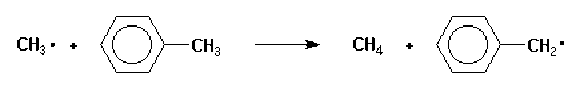
Pour les radicaux aliphatiques, l'ordre de stabilité décroissante est : tertiaire > secondaire > primaire.
Les complexes
En dehors des molécules classiques énergétiquement activées, des atomes, des radicaux ou des ions, on a pu mettre en évidence des associations entre molécules ou entre ions et molécules d'une stabilité relative auxquelles on donne le nom général de complexes. Ces complexes peuvent intervenir comme intermédiaires réactionnels.
Exemples : associations avec \(\textrm{BF}_3\), \([\textrm{BF}_3,\textrm{CH}_3\textrm{COOH}]\) , avec \(\textrm{AlCl}_3\), formation de dimères,
Exemple de complexe avec les métaux :

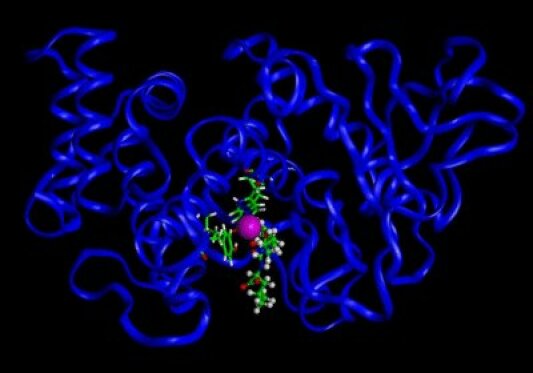
Les complexes formés avec les enzymes constituent des intermédiaires réactionnels essentiels aux transformations biochimiques.
Exemple :
L'enzyme de la thermolysine (représenté en ruban bleu) qui réussit à cliver une séquence protéinique (partie en boule et bâtons) grâce à un ion \(\textrm{Zn}^{2+}\) (boule rose) qui se trouve bloqué dans son site par plusieurs acides aminés de l'enzyme (représentés en bâtons).
Image calculée et fournie par le Centre de Modélisation et d'Imagerie Moléculaire (CMIM) de l'Université de Nice Sophia-Antipolis.