Degrés d'oxydation et chimie rédox
La chimie des éléments \(\textrm d\) est largement gouvernée par la formation d'ions. Les métaux de transition étant dans leur grande majorité très électropositifs (l'électronégativité n'excède pas 2,5, cas de l'or), ils forment facilement des complexes. Leur caractéristique la plus importante est la gamme étendue de leur degré d'oxydation.
A l'exception de \(\textrm{Hg}\), les éléments extrêmes de chaque période du bloc \(\textrm d\) n'ont qu'un seul degré d'oxydation différent de zéro.
Exemple :
\(\textrm{Sc}\) \(\textrm{Sc}^{3+}\) (seulement)
\(\textrm{Zn}\) \(\textrm{Zn}^{2+}\) (seul DO du zinc)
Tous les autres éléments de la période peuvent avoir au moins 2 degrés d'oxydations.
Exemple : Le cuivre
Le cuivre entre dans la composition d'un grand nombre de sels au degré d'oxydation II ou I, par exemple : \(\textrm{CuCl}_2\) ou \(\textrm{CuCl}\).
En raison de la structure électronique des éléments \(\textrm d\), le degré d'oxydation le plus répandu est +2, car il correspond à l'extraction des deux électrons \(\textrm s\) de la couche externe.
Les éléments du centre du bloc \(\textrm d\) ont fréquemment des degrés d'oxydation plus élevés.
Exemple : Le ruthénium
Le ruthénium donne 9 degrés d'oxydation :
\([\textrm{Ru}^{-\textrm{II}}(\textrm{CO})_4]^{2-}, [\textrm{Ru}^0(\textrm{CO})_5], [\textrm{Ru}^{+\textrm{II}}(\textrm{NH}_3)_6]^{2+}, [\textrm{Cl Ru}^{+\textrm{III}}(\textrm{NH}_3)_5]^{2+},\\~ [\textrm{Ru}^{+\textrm{IV}} (\textrm{Cl})_6]^{2-}, \textrm{Ru}^{+\textrm V}\textrm F_5, \textrm{Ru}^{+\textrm{VI}}\textrm F_6, [\textrm{Ru}^{+\textrm{VII}}\textrm O_4]^-, \textrm{Ru}^{+\textrm{VIII}}\textrm O_4\)
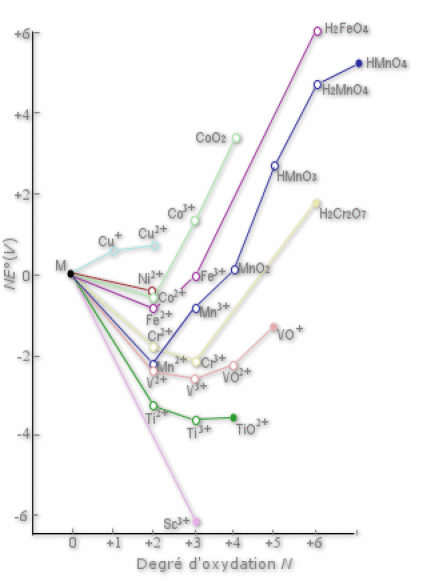
Du fait de ces nombreux degrés d'oxydation stables, les éléments \(\textrm d\) possèdent donc une chimie rédox très riche. Les degrés d'oxydation inférieurs donnent un caractère réducteur à l'espèce considérée, tandis que les degrés d'oxydation supérieurs donnent un caractère oxydant. Le vanadium, le chrome et le manganèse sont les espèces dont la chimie rédox est la plus intéressante. En effet, de nombreuses réactions utilisées en chimie analytique font intervenir ces ions.
Figure 9. Un alcootest
L'alcool (\(\textrm C_2 \textrm H_5 \textrm{OH}\)) est absorbé par le sang puis libéré dans l'air par la respiration. Au cours d'un alcootest, l'air est expiré dans un sac en plastique : l'alcool qu'il contient transforme le dichromate de potassium (\(\textrm K_2 \textrm{Cr}_2 \textrm O_7\)), jaune, en \(\textrm{Cr}_\textrm{aqueux}^{3+}\), qui est de couleur verte. L'alcool (l'éthanol) est oxydé en acide acétique \(\textrm{CH}_3 \textrm{COOH}\) suivant le bilan :
\(3\textrm C_2\textrm H_5 \textrm{OH}_\textrm{aqueux} + {2 \textrm{Cr}_2^\textrm{VI} \textrm O_7^{2-}}_\textrm{ aqueux}+ 16\textrm H^+ \to 3\textrm{CH}_3 \textrm{COOH}_\textrm{aqueux} + 4\textrm{Cr}_\textrm{aqueux}^{3+} + 11 \textrm H_2 \textrm O\)
La quantité d'alcool présente dans l'air expiré est directement proportionnelle à la diminution de la concentration de \(\textrm{Cr}_2 \textrm O_7^{2-}\).