Rappel introductif : qu'est ce qu'un complexe ?
Définition :
Un complexe est obtenu en effectuant une réaction acide-base de Lewis entre :
un métal (acide de Lewis)
un ligand (base de Lewis) (figure ci dessous)

Exemple :
La formation de \([\textrm{Co}(\textrm{NH}_3)_6]^{3+}\) est une réaction acide-base selon Lewis.
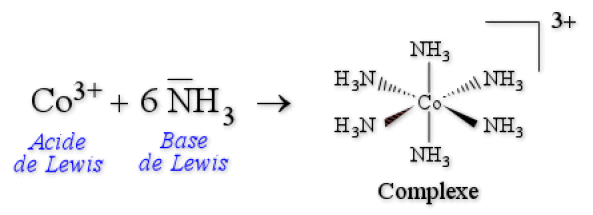
Dans l'octaèdre, les ligands se situent au centre des faces d'un cube, le métal se trouvant au centre de ce cube.
Historique : complexes de Werner
Werner (Prix Nobel 1913) a étudié une série de complexes \(\textrm{Co}^\textrm{III}\textrm{Cl}_3, \textrm{n}\textrm{NH}_3\). Il a mis en évidence des propriétés chimiques différentes :
\(\textrm{CoCl}_3, 6.\textrm{NH}_3(1) + \textrm{Ag}^+_\textrm{excés}\to 3.\textrm{AgCl}_\textrm{solide}\)
\(\textrm{CoCl}_3, 5.\textrm{NH}_3(2) + \textrm{Ag}^+_\textrm{excés}\to 2.\textrm{AgCl}_\textrm{solide}\)
\(\textrm{CoCl}_3, 4.\textrm{NH}_3(3) + \textrm{Ag}^+_\textrm{excés}\to 1.\textrm{AgCl}_\textrm{solide}\)
Werner en a conclu que le cobalt est toujours entouré de six ligands dans ce type de composés. Il a introduit la notation suivante pour les complexes (1), (2) et (3) :
\([\textrm{Co}(\textrm{NH}_3)_6]\textrm{Cl}_3\textrm{ }(1)\)
\([\textrm{Co}(\textrm{NH}_3)_5\textrm{Cl}]\textrm{Cl}_2\textrm{ }(2)\)
\([\textrm{Co}(\textrm{NH}_3)_4\textrm{Cl}_2]\textrm{Cl}\textrm{ }(3)\)
Les espèces en dehors des crochets ne font pas partie du complexe. Elles permettent de maintenir l'électroneutralité du solide. Ce sont des contre-ions (dans le cas de \(\textrm{Cl}^-\) des contre-anions).
Suivant les complexes, zéro, un ou deux ions chlorures sont liés au cobalt.
A l'image de la chimie organique, il existe une nomenclature pour les composés inorganiques (recommandations de l'IUPAC). A titre indicatif, voici le nom des composés (1), (2) et (3) dans cette nomenclature :
(1) : chlorure d'hexaamminecobalt(III)
(2) : chlorure de pentaamminechlorocobalt(III)
(3) : chlorure de tétraamminedichlorocobalt(III)