Polyhalogénures
Les halogénures \(\textrm X^-\) possèdent 4 doublets non liants, qui leur confèrent donc un caractère de base de Lewis. Par contre, sur les composés halogénés (dihalogènes ou interhalogénés), il existe des niveaux électroniques vides. Ainsi, par réaction de type acide-base de Lewis (partage de doublet), on forme des ions polyhalogénures. Les plus communs contiennent de l'iode.
Exemple : Quelques polyhalogénures
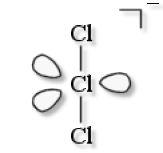
\(\textrm{Cl}_3^-\)
VSEPR : \(\textrm{AX}_2\textrm E_3\)
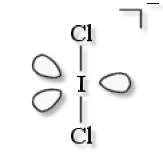
\(\textrm{ICl}^-_2\)
VSEPR : \(\textrm{AX}_2\textrm E_3\)
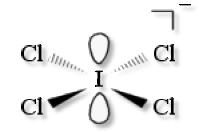
\(\textrm{ICl}^-_4\)
VSEPR : \(\textrm{AX}_4\textrm E_2\)