Pour en savoir plus : les principaux types structuraux
Parmi les structures type de la cristallographie, on trouve énormément de chlorures. Quelques structures classiques sont présentées ici.
Réseaux 3D
Comme il a été dit précédemment, les réseaux 3D sont à caractère ionique et concernent des cations d'éléments des colonnes 1 et 2.
Exemple : Types structuraux pour MClx
\(\textrm{MCl}\)
\(\textrm{CsCl}\)
Exemple : \(\textrm{CsCl}\)
Coordinence [\(\textrm{M}\)] :[8]
Coordinence [\(\textrm{Cl}^-\)] :[8]

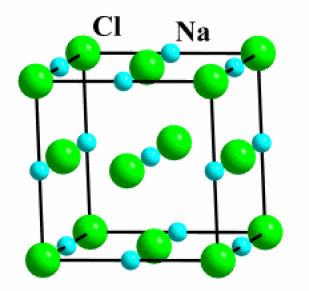
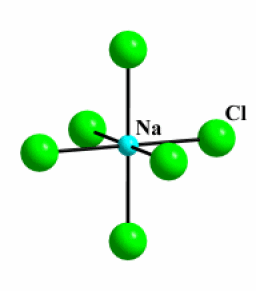
\(\textrm{NaCl}\)
Exemple : \(\textrm{NaCl}\)
Coordinence [\(\textrm{M}\)] :[6]
Coordinence [\(\textrm{Cl}^-\)] :[6]
\(\textrm{MCl}_2\)
rutile
Exemple : \(\textrm{CaCl}_2\)
Coordinence [\(\textrm{M}\)] :[6]
Coordinence [\(\textrm{Cl}^-\)] :[3]


fluorine
Exemple : \(\beta -\textrm{BaCl}_2\)
Coordinence [\(\textrm{M}\)] :[8]
Coordinence [\(\textrm{Cl}^-\)] :[4]


Remarque :
Il n'existe pas de composés tridimensionnels dans la stœchiométrie \(\textrm{MCl}_3\) car \(\textrm M^{3+}\) est trop polarisant pour \(\textrm{Cl}^-\). On augmente donc fortement la covalence ce qui induit une diminution de la dimensionnalité (voir ci-dessus).
Réseaux 2D (couches)
Ces réseaux sont obtenus avec des éléments de transition ; ils ont un caractère covalent surtout localisé dans les plans, les interactions entre plans étant davantage à caractère intermoléculaire (van der Waals).
Exemple : Tableau de types structuraux 2D pour MClx
\(\textrm{MCl}_2\)
Type \(\textrm{CdI}_2\)
Exemple : \(\textrm{CdCl}_2\)
Coordinence [\(\textrm{M}\)] :[6]
Coordinence [\(\textrm{Cl}^-\)] :[3]



\(\textrm{MCl}_3\)
Type \(\textrm{CdI}_2\) lacunaire
Exemple : \(\textrm{FeCl}_3\)
Coordinence [\(\textrm{M}\)] :[6]
Coordinence [\(\textrm{Cl}^-\)] :[2]


