Les oxoacides de chlore
Il existe 4 oxoacides du chlore, associés aux degrés d'oxydation positifs impairs. Ils présentent une évolution régulière de l'acidité en fonction du degré d'oxydation.
\(\textrm{HOCl}\)
Degré d'oxydation du \(\textrm{Cl}\) : +I
Nom usuel : acide hypochloreux
Nom nomenclature IUPAC : acide monooxochlorique
Base conjuguée : \(\textrm{ClO}^-\)
Nom usuel de la base associée : hypochlorite
Nom nomenclature IUPAC : monooxochlorate
\(pK_a\) : 7,53
\(\textrm{HClO}_2\)
Degré d'oxydation du \(\textrm{Cl}\) : +III
Nom usuel : acide chloreux
Nom nomenclature IUPAC : acide dioxochlorique
Base conjuguée : \(\textrm{ClO}_2^-\)
Nom usuel de la base associée : chlorite
Nom nomenclature IUPAC : dioxochlorate
\(pK_a\) : 2,0
\(\textrm{HClO}_3\)
Degré d'oxydation du \(\textrm{Cl}\) : +V
Nom usuel : acide chlorique
Nom nomenclature IUPAC : acide trioxochlorique
Base conjuguée : \(\textrm{ClO}^-_3\)
Nom usuel de la base associée : chlorate
Nom nomenclature IUPAC : trioxochlorate
\(pK_a\) : -1,2
\(\textrm{HClO}_4\)
Degré d'oxydation du \(\textrm{Cl}\) : +VII
Nom usuel : acide perchlorique
Nom nomenclature IUPAC : acide tétraoxochlorique
Base conjuguée : \(\textrm{ClO}_4^-\)
Nom usuel de la base associée : perchlorate
Nom nomenclature IUPAC : tétraoxochlorate
\(pK_a\) : -10
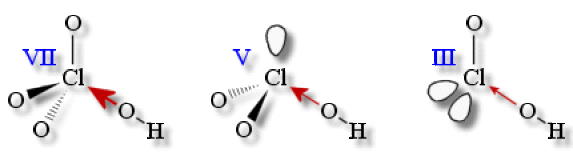
La force de l'acide \(\textrm{HClO}_n\) dont la structure peut être représentée par : \(\textrm{}^{\delta+}\textrm{H}-^{\delta-}\textrm O-\textrm{Cl}-...\) augmente avec la polarisation de la liaison \(\textrm{}^{\delta+}\textrm{H}-^{\delta-}\textrm{O}\). Plus il y a d'oxygènes connectés à \(\textrm{Cl}\), et plus cette polarisation augmente à cause :
de l'effet inducteur attractif de l'oxygène,
de l'augmentation de l'électronégativité apparente de \(\textrm{Cl}\) avec son D.O., ce qui rend l'hydrogène plus labile (son départ est plus facile).