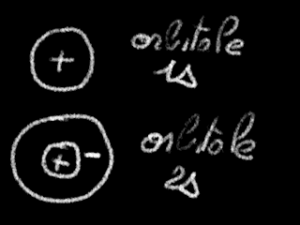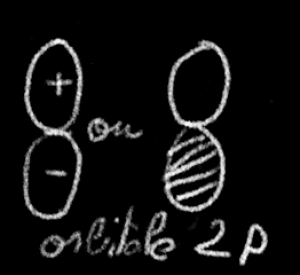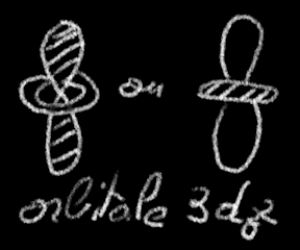Représentation schématique des orbitales
Les représentations des orbitales que l'on vient de contempler sont évidemment difficiles à reproduire. Pourtant, les chimistes ont besoin de manipuler ces objets théoriques qui leur permettent de proposer des modèles d'interprétation des propriétés des atomes, des molécules et des assemblages plus complexes. Pour éviter que l'effort de représentation ne les décourage, il convient de définir une représentation minimale qui donne les indications importantes sur les types d'orbitales, leurs éléments de symétrie et leurs éléments nodaux.
On a représenté ci-dessous les dessins les plus usuels qui permettent de représenter les orbitales \(\textrm s, \textrm p \textrm{et} \textrm d\).
Les orbitales \(\textrm s\) sont de symétrie sphérique ; on les représente par un cercle. Il est utile de préciser les signes.
Dans une orbitale \(1\textrm s\), l'orbitale est toujours positive. Dans l'orbitale \(2\textrm s\) par contre, c'est la zone située à l'extérieur de la sphère nodale qui rassemble la plus grande partie du nuage. Cette zone est négative. On représente alors deux cercles concentriques.
Le signe plus est interne, le signe moins externe.
Les orbitales \(2\textrm p\) sont représentées par deux lobes de signe opposé. On grise (hachure) un des lobes pour distinguer les signes ; on peut aussi les porter explicitement sur le dessin.
Ces représentations figurent alors l'orientation dans l'espace du nuage électronique, l'existence du plan nodal et la symétrie de révolution autour d'un axe particulier.
On perd bien sûr dans ces schémas tout le détail de l'évolution de la densité de probabilité de présence dans l'espace. On se gardera aussi de penser que ces dessins représentent des surfaces à l'intérieur desquelles sont enfermés les électrons...