Les symétries des orbitales
Chaque orbitale moléculaire est caractérisée par la manière dont elle se transforme sous l'action des éléments de symétrie de la molécule.
Pour classer les orbitales moléculaires suivant leur symétrie, il faut d'abord identifier les éléments de symétrie de la molécule qui sont liés à sa géométrie telle que définie par la position des noyaux.
Dans le cas d'une molécule diatomique \(\textrm{AB}\), on place les deux atomes sur un axe d'un référentiel cartésien dont l'origine est placée au centre de gravité (par convention on prendra pour axe de la liaison l'axe \(\textrm Oz\)).
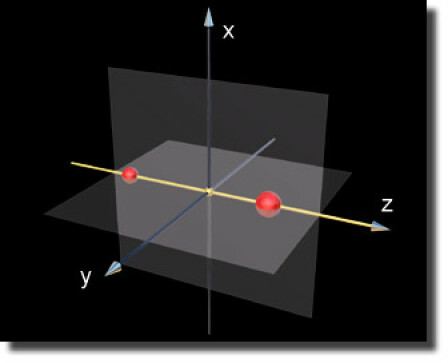
Eléments de symétrie d'une diatomique hétéronucléaire
On identifie alors comme élément principal de symétrie l'axe de la liaison qui est un axe de révolution. Les deux plans \(x\textrm Oz\) et \(y\textrm Oz\) sont des éléments de symétrie inférieure.
Les orbitales moléculaires invariantes par rotation autour de l'axe de la liaison sont dites de symétrie \(\sigma\).
Les orbitales antisymétriques (qui changent de signe) par un des plans sont dites de symétrie \(\pi\).
Remarque :
Il y a d'autres types de symétries (\(\delta,\varphi\)) que l'on n'abordera pas ici et qui concernent des orbitales atomiques de couches supérieures (orbitales \(\textrm d\), \(\textrm f\)).