Polarisation des liaisons
L'absence de symétrie centrale dans la molécule se traduit sur le diagramme de corrélation illustré ci-dessous. L'énergie de la première orbitale moléculaire est plus proche de l'énergie de l'OA de plus basse énergie. La seconde OM est plus proche de l'OA de plus haute énergie.
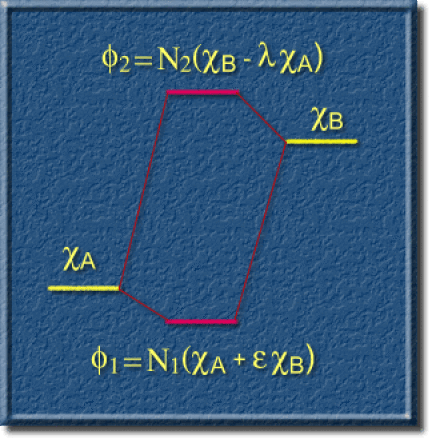
La proximité énergétique se traduit aussi dans la forme des OM. On les a exprimées ici de manière différente pour montrer que la première OM ressemble plus à l'OA \(\chi_\textrm A (\epsilon<1)\) ; de même, la seconde OM ressemble plus à l'OA \(\chi_{\textrm{B}} (\lambda<1)\).
Dans le cas où les deux atomes fournissent chacun un électron pour former une liaison covalente, ces deux électrons sont décrits, dans la molécule formée, par une OM fortement localisée sur l'atome \(\textrm A\). La formation de la liaison s'accompagne donc d'un déplacement de la densité vers l'atome dont l'orbitale est de plus basse énergie, le plus électronégatif.
Ce déplacement est la conséquence de la différence d'électronégativité entre les deux atomes. Il est à l'origine de l'apparition d'un moment dipolaire.