N2 et O2
Durée : 10 mn
Note maximale : 6
Question
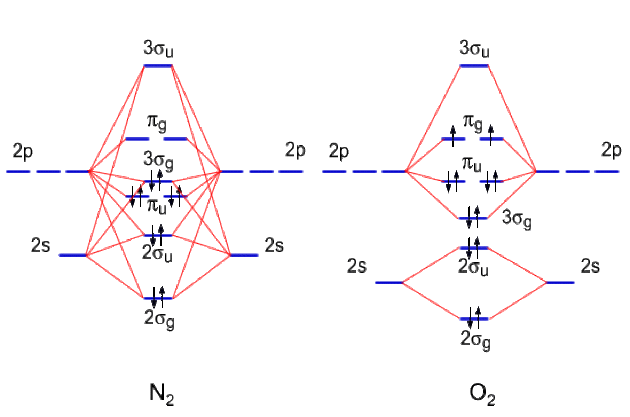
Etablir les diagrammes de corrélation de valence des molécules\(\textrm{N}_{2}\)et\(\textrm{O}_{2}\)en indiquant les symboles de symétrie des orbitales moléculaires.
Indiquer si ces molécules sont para ou diamagnétiques.
Solution
La molécule\(\textrm{N}_{2}\)contient 10 électrons de valence. La molécule\(\textrm{O}_{2}\)contient 12 électrons de valence.
Les diagrammes sont donnés ci-dessous.L'ordre énergétique des OM\(3\sigma_{g}\)et\(\pi_{u}\)s'inverse entre\(\textrm{N}_{2}\)et\(\textrm{O}_{2}\)en raison de la diminution du mélange 2s-2p dans les OM de symétrie\(\sigma\). Pour cette dernière molécule, on peut ne considérer que des combinaisons à deux OA.
Les règles de remplissage conduisent au peuplement des OM\(\pi_{u}\)du dioxygène avec deux électrons. Ils se disposent chacun sur une des combinaisons et leurs spins sont identiques. La molécule est paramagnétique.
Dans\(\textrm{N}_{2}\), tous les électrons sont appariés et la molécule est diamagnétique.