Cálculo de los avances
CH4 | C2H6 | O2 | CO2 | H2O | |
|---|---|---|---|---|---|
ni,0 | 0,5 | 1,0 | Exceso | 0,0 | 0,0 |
ni | 0,0 | 0,0 | Resto | 2,5 | 4,0 |
ni - ni,0 | -0,5 | -1,0 | -4,5 | 2,5 | 4,0 |
Para calcular el avance de una reacción, debemos utilizar un reactivo o un producto que no intervenga en esta reacción. Para la reacción
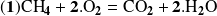
Se trata del metano.
Donde :
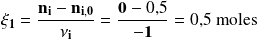
Observación :
Si utilizáramos las cantidades totales de las otras sustancias (
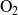 ,
,
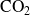 o
o
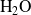 ) cometeríamos un error... por que no son consumidas o producidas por la única reacción (1).
) cometeríamos un error... por que no son consumidas o producidas por la única reacción (1).
Sin embargo, es posible, siempre y cuando utilicemos las cantidades consumidas o producidas por la única reacción (1).
Así, para el oxígeno molecular, la cantidad consumida total es de 4,5 moles. Pero solamente 1,0 mol es consumido por la reacción (1). Es decir -1 para considerar el hecho de que se trata de una cantidad desaparecida.
Donde:
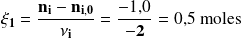
Encontramos el mismo valor que con el metano.
De la misma manera, para la reacción :
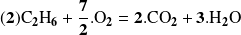
Observación :
Obtendríamos el mismo resultado utilizando las cantidades de las otras sustancias consumidas o producidas por la única reacción (2).
Así, para el oxígeno molecular, la cantidad consumida total es de 4,5 moles. Pero solamente 3,5 moles son consumidos por la reacción (2).
Son -3,5 para tomar en cuenta ya que se trata de una cantidad desaparecida.
Donde:

Encontramos el mismo valor que con el etano.
Recordatorio :
Para calcular el avance de una reacción, debemos utilizar un reactivo o un producto que no intervenga en esta reacción. Si nos referimos a un reactivo o un producto que interviene en varias reacciones, hay que utilizar las cantidades consumidas o producidas por el único juego de la reacción considerada.
