Réactions d'ordre 0
Loi de vitesse
Les réactions d'ordre 0 sont des réactions dont la vitesse ne dépend pas de la concentration des réactifs, la vitesse est donc constante.
Evidemment, cette vitesse ne peut se maintenir constante que tant qu'il reste du réactif.
Expression de la vitesse \(\mathbf{\textrm v=-\frac{\textrm dC}{\textrm dt}=\textrm{Cte}}\) qui s'intègre en
\(\mathbf{C_0-C=k.t}\) \(k \textrm{en mol.L}^{-1}\textrm{.s}^{-1}\)
\(C_0\) étant la concentration initiale du réactif et \(C\) sa concentration au temps \(t\).
Si vous désirez consulter des détails concernant l'intégration, cliquez ici[1].
Temps de demi-vie
Le temps de demi-vie ou période \(t_{\frac12}\) est égal à :
\(\mathbf{t_{\frac12}=\frac{C_0}{2.k}}\)
Elle est donc proportionnelle à la concentration initiale.
Si vous désirez consulter un rappel concernant la période, cliquez ici[2].
Vérification de l'ordre
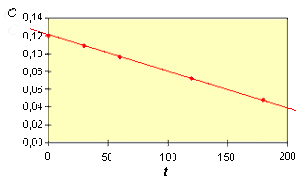
La loi de vitesse intégrée \(\mathbf{C_0-C=k.t}\) (\(k \textrm{en mol.L}^{-1}\textrm{.s}^{-1}\)) montre qu'en portant sur un graphique la concentration \(C\) en fonction du temps, on doit obtenir une droite de pente \(- k\).

On peut aussi, pour chaque mesure expérimentale, calculer les valeurs du coefficient de vitesse \(k\) suivant la loi d'ordre 0 :
\(\mathbf{k=\frac{C_0-C}{t}}\) et s'assurer que ces valeurs sont sensiblement constantes.
Exemple :
On a relevé les valeurs suivantes :
t (s) | 0 | 30 | 60 | 120 | 180 |
|---|---|---|---|---|---|
C (mol.L-1) | 0.120 | 0.109 | 0.096 | 0.072 | 0.048 |
En portant sur un graphique \(C = f(t)\) on obtient :
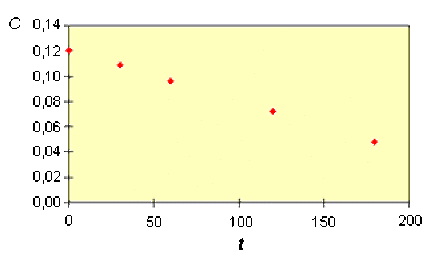
On peut aussi calculer les valeurs du coefficient de vitesse. On trouve :
t (s) | 0 | 30 | 60 | 120 | 180 |
|---|---|---|---|---|---|
C (mol.L-1) | 0,120 | 0,109 | 0,096 | 0,073 | 0,049 |
k \(\times\) 104 | 3,67 | 4,00 | 3,92 | 3,94 |
Cliquez ici[3] si vous voulez des détails sur le calcul de \(k\). On note une différence entre la plus forte valeur et la plus grande de 0,33x10-4 soit environ 8 % ce qui peut sembler un écart important. Cependant, on doit tenir compte de l'incertitude sur les mesures.
Cliquez ici[4] si vous voulez des détails sur le calcul d'incertitude. Si on considère que les concentrations sont connues avec 3 chiffres significatifs et les mesures de temps à 1 s près, un calcul d'incertitude montre que pour le temps \(t = 30\textrm{ s}\) la précision sur \(k\) n'est que de 20 %. L'écart maximum observé (8 %) est donc bien dans l'incertitude.
Nota : pour le temps \(t = 180\), l'incertitude sur \(k\) tombe à 3 %.
Remarque :
Les réactions d'ordre zéro sont rares. Il ne peut pas s'agir d'une réaction élémentaire, on est donc dans le cas d'une dégénérescence d'ordre. Il s'agit toujours de réactions hétérogènes dont la vitesse est limitée par la surface de contact entre phases.
La décomposition du pentoxyde de diazote \(\textrm N_2\textrm O_5\) solide en \(\textrm{NO}_2\) et \(\textrm O_2\) est limitée par la sublimation du solide, celle-ci ne dépend pas de la concentration. La réaction est donc d'ordre 0 ; alors que si on opère directement en phase gazeuse elle est d'ordre 1.
La décomposition de \(\textrm{PH}_3 (\textrm g)\) (phosphine) au contact d'un filament de tungstène chauffé se fait à vitesse constante. Cette vitesse dépend de la surface active du filament de tungstène. La réaction subit une catalyse hétérogène qui fixe la vitesse, donc impose un ordre égal à zéro.