Réaction d'ordre 1
Loi de vitesse
L'expression de la vitesse est proportionnelle à la concentration d'un réactif \(\textrm A\) :
\(\mathbf{\textrm v=-\frac{\textrm dC_\textrm A}{\textrm dt}=k.C_\textrm A}\) qui s'intègre en :
\(\mathbf{\ln\frac{C_\textrm A}{C_{\textrm A0}}=-k.t}\) ou \(\mathbf{\ln\frac{C_{\textrm A0}}{C_\textrm A}=k.t} k \textrm{en s}^{-1}\)
\(C_{\textrm A0}\) étant la concentration initiale de \(\textrm A\) et \(C_\textrm A\) sa concentration au temps \(t\).
Si vous désirez consulter des détails concernant l'intégration, cliquez ici[1].
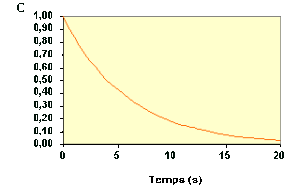
De l'expression précédente, on tire facilement la relation qui permet de calculer la concentration de \(\textrm A\) à un instant \(t\) :
\(\mathbf{C_\textrm A=C_{\textrm A0}.\exp(-k.t)}\)
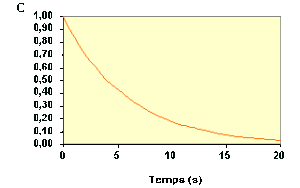
La variation de \(C_\textrm A\) au cours du temps suit donc une courbe de décroissance exponentielle :
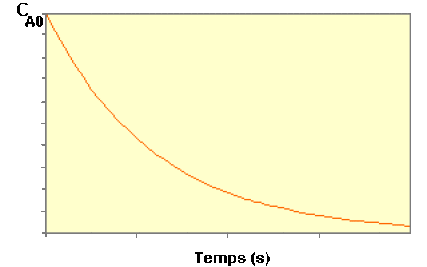
Cliquez ici[2] pour voir d'autres formes de la loi de vitesse.
Remarque :
Dans ce qui précède, on a utilisé la vitesse volumique \(\textrm v\), on aurait tout aussi bien pu utiliser la vitesse \(\omega\) exprimée à partir de l'avancement de réaction \(\xi\) .
Temps de demi-vie
Le temps de demi-vie (ou période) \(t_{\frac12}\) est égal à \(\mathbf{t_{\frac12}=\frac{\ln2}{k}}\) et est donc indépendant de la concentration initiale.
Si vous désirez consulter un rappel concernant la période, cliquez ici[3].
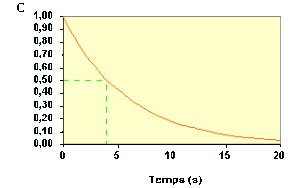
Le temps de demi-vie peut se déterminer facilement à partir de la courbe \(C_\textrm A = f (t)\) .
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Le fait que le temps de demi-vie soit indépendant de la concentration initiale est caractéristique des réactions d'ordre 1.
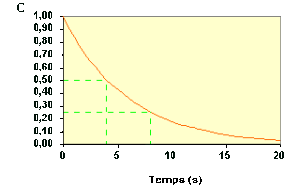
A partir d'une même courbe \(C_\textrm A = f (t)\), on peut déterminer plusieurs temps de demi-vie successifs.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Il est même possible de déterminer des temps de demi-vie qui se chevauchent.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Vérification de l'ordre 1 d'une réaction
Position du problème :
On étudie une réaction et on désire s'assurer qu'elle obéit bien à une loi du premier ordre. Si c'est bien le cas, on veut déterminer son coefficient de vitesse. Selon les cas, on peut effectuer cette vérification à partir :
des valeurs des temps de demi-vie
des valeurs des vitesses correspondantes à différentes concentrations
des valeurs de concentration mesurées au cours du temps.
Le premier cas est le plus simple, il suffit de s'assurer que le temps de demi-vie est indépendant de la concentration.
La vérification à partir des vitesses est un peu plus simple qu'à partir des concentrations (3ème cas), mais risque d'être moins précise (car en général les vitesses sont déterminées avec moins de précision que les concentrations).
Explication :
Vérification à partir des temps de demi-vie
Dans certains cas, on connaît le temps de demi-vie pour plusieurs expériences effectuées avec des concentrations initiales différentes. Si ces expériences ont toutes été effectuées dans les mêmes conditions (notamment de température), le fait que le temps de demi-vie soit constant suffit à établir que la réaction est du premier ordre. Il est également possible de vérifier la constance du temps de demi-vie sur une seule expérience.
Vérification à partir des vitesses
On suppose que l'on dispose de valeurs de la vitesse de réaction \(\textrm v\) correspondantes à plusieurs valeurs de la concentration \(C_\textrm A\).
Pour vérifier la loi de vitesse \(\mathbf{\textrm v=-\frac{\textrm dC_\textrm A}{\textrm dt}=k.C_\textrm A}\) il suffit de vérifier que la vitesse \(\textrm v\) est proportionnelle à \(C_\textrm A\).
On peut le faire soit graphiquement soit numériquement.
Vérification à partir des concentrations
On suppose que l'on dispose de valeurs de la concentration \(C_\textrm A\) pour diverses valeurs du temps.
Pour vérifier la loi de vitesse, on utilisera sa forme intégrée \(\mathbf{\ln\frac{C_\textrm A}{C_{\textrm A0}}=-k.t}\).
On peut le faire soit graphiquement soit numériquement.
De manière graphique on porte \(\ln C_\textrm A\) en fonction de \(t\) et on s'assure que les points s'alignent sur une droite.
La pente de la droite est égale à \(– k\) et l'ordonnée à l'origine est égale \(\ln C_{\textrm A0}\).
On peut aussi porter \(\mathbf{\ln\frac{C_{\textrm A0}}{C_\textrm A}}\) en fonction de \(t\). Les points doivent s'aligner sur une droite de pente \(k\) passant par l'origine.
De manière numérique, on calcule le coefficient de vitesse \(k\) par la relation \(\mathbf{k=\frac{1}{t}\times\ln\frac{C_{\textrm A0}}{C_\textrm A}}\) pour les divers couples de valeurs de \(C_\textrm A , t\) et on s'assure que ces valeurs sont sensiblement constantes.
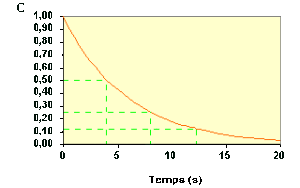
Exemple : Vérification de l'ordre 1 à partir du temps de demi-vie
Cherchons à le confirmer en déterminant la date pour \(C = \textrm{0,125}\). On trouve : \(t_3 = \textrm{12,2 s}\) .
La troisième période vaut donc : \(t_3 – t_2 = \textrm{12,2} – \textrm{8,2} = \textrm{4,0 s}\).
Ainsi, la valeur du temps de demi-vie déterminée pour différentes concentrations est sensiblement constante \(t_1 = \textrm{4,0 s}\) ; \(t_2 – t_1 = \textrm{4,2 s}\) et \(t_3 – t_2 = \textrm{4,0 s}\).
Ceci permet de conclure que la réaction obéit à une loi d'ordre 1.
Remarque :
Dans cet exemple, les temps de demi-vie sont très voisins. Il peut se faire que, compte tenu des erreurs expérimentales, on trouve des temps de demi-vie légèrement différents bien que la réaction soit du premier ordre.
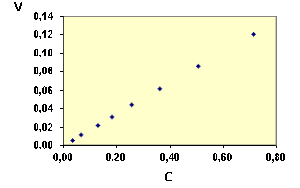
Exemple : Vérification de l'ordre 1 à partir des vitesses
On a trouvé les résultats suivants :
t (s) | 2 | 4 | 6 | 8 | 10 | 12 | 16 | 20 |
|---|---|---|---|---|---|---|---|---|
v mol.L-1.s-1 | 0,121 | 0,086 | 0,061 | 0,044 | 0,031 | 0,022 | 0,011 | 0,006 |
Pour chaque point, on relève aussi la concentration, que l'on porte dans le même tableau.
t (s) | 2 | 4 | 6 | 8 | 10 | 12 | 16 | 20 |
|---|---|---|---|---|---|---|---|---|
v mol.L-1.s-1 | 0,121 | 0,086 | 0,061 | 0,044 | 0,031 | 0,022 | 0,011 | 0,006 |
C mol.L-1 | 0,071 | 0,051 | 0,036 | 0,026 | 0,018 | 0,013 | 0,007 | 0,003 |
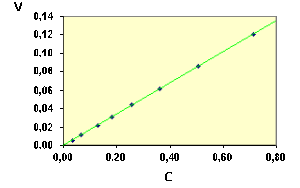
On peut faire la vérification de la relation \(\textrm v = k. C_\textrm A\) soit numériquement, soit graphiquement.
De manière numérique, on calcule \(k\) pour les diverses valeurs de \(C_\textrm A\) et on s'assure que ces valeurs sont sensiblement constantes. On trouve les valeurs suivantes :
On observe que pour les derniers points les valeurs s'écartent de celles obtenues pour les premiers points ; il est facile de voir que la précision sur ces deux derniers points est sensiblement moins grande.
Remarque :
Dans cet exemple, les points représentant la vitesse en fonction du temps sont parfaitement alignés. Il n'en sera pas toujours de même avec des valeurs expérimentales à cause de l'imprécision sur la détermination de la vitesse.
Exemple : Vérification de l'ordre 1 à partir des concentrations
La variation de concentration du réactif \(\textrm A\) au cours du temps d'une réaction est représentée sur la figure ci-dessous :
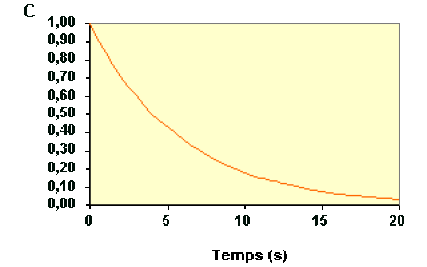
La loi de vitesse sous sa forme intégrée s'écrit :
\(\mathbf{\ln\frac{C_{\textrm A0}}{C_\textrm A}=k.t} k \textrm{en s}^{-1}\)
En portant \(\mathbf{\ln\frac{C_{\textrm A0}}{C_\textrm A}}\) en fonction du temps, on doit trouver une droite de pente \(k\).
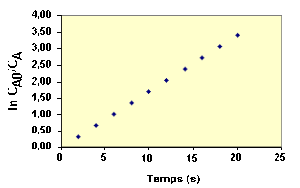
Exemple : Autre exemple de vérification de l'ordre 1 à partir des concentrations
La variation de concentration du réactif \(\textrm A\) au cours du temps d'une réaction est représentée sur la figure ci-dessous :
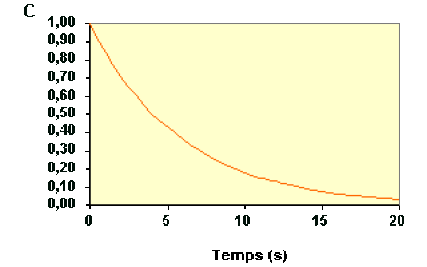
La loi de vitesse sous sa forme intégrée s'écrit :
\(\mathbf{\ln\frac{C_{\textrm A0}}{C_\textrm A}=k.t } k \textrm{en s}^{-1}\)
On peut donc calculer la valeur de \(k\) pour chaque point par la relation :
\(\mathbf{k=\frac{1}{t}\ln\frac{C_{\textrm A,0}}{C_\textrm A}} k \textrm{en s}^{-1}\)
Avec 10 points de la courbe précédente, on trouve des valeurs constantes égales à 1,7 s-1, ce qui montre que la réaction obéit à une loi d'ordre 1.
\(k=\frac{1}{t}\ln\frac{C_{\textrm A0}}{C_\textrm A} k \textrm{en s}^{-1}\)
Avec 10 points de la courbe précédente, on trouve des valeurs constantes égales à 1,7 s-1, ce qui montre que la réaction obéit à une loi d'ordre 1.
Remarque :
Dans cet exemple, les points représentant \(\ln\frac{C_{\textrm A0}}{C_\textrm A}\) en fonction du temps sont parfaitement alignés. Il n'en sera pas de même avec des valeurs expérimentales à cause de l'imprécision sur les mesures.
Vous pouvez voir ci-dessous différents exemples de réactions d'ordre 1 :
réactions de décomposition en phase gazeuse
réactions en solution
réactions de désintégrations nucléaires
Exemple : Réactions de décomposition en phase gazeuse
Un grand nombre de réactions de décomposition en phase gazeuse suivent une loi de vitesse du premier ordre. Citons-en quelques unes à titre d'exemple :
Décomposition de l'azométhane :
\(\mathbf{\textrm{CH}_3\textrm N_2\textrm{CH}_3 (\textrm g) = \textrm{CH}_3\textrm{CH}_3 (\textrm g) + \textrm N_2 (\textrm g)}\)
Décomposition du chlorure de thionyle :
\(\mathbf{\textrm{SO}_2\textrm{Cl}_2 (\textrm g) = \textrm{SO}_2 (\textrm g) + \textrm{Cl}_2 (\textrm g)}\)
Décomposition du pentoxyde de diazote :
\(\mathbf{\textrm N_2\textrm O_5 (\textrm g) = 2. \textrm{NO}_2 (\textrm g) + \frac{1}{2}. \textrm O_2 (\textrm g)}\)
Si ces réactions sont conduites à volume et température constants, on pourra suivre leur évolution par la variation de pression totale du système.
Exemple : Réactions en solution
Il existe aussi des réactions en solution qui suivent une loi d'ordre 1. Par exemple :
Décomposition du peroxyde d'hydrogène en solution aqueuse (eau oxygénée) :
\(\mathbf{2.\textrm H_2\textrm O_2 (\textrm{aq}) = 2.\textrm H_2\textrm O (\textrm l) + \textrm O_2 (\textrm g)}\)
Cette réaction peut être suivie en mesurant le volume de dioxygène dégagé.
Hydrolyse en milieu aqueux de certains chlorures organiques :
\(\mathbf{\textrm R-\textrm{Cl} (\textrm{aq}) + \textrm H_2\textrm O (\textrm l) = \textrm{ROH} (\textrm{aq}) + \textrm{HCl} (\textrm{aq})}\)
Cette réaction peut être suivie en dosant la quantité de \(\textrm{HCl}\) formée.
Exemple : Réactions nucléaires
Bien que les réactions nucléaires ne puissent être considérées, à proprement parler, comme des réactions chimiques, nous les évoquerons brièvement ici.
Les réactions de désintégration nucléaires obéissent à une loi d'ordre un. En général, on s'intéresse au nombre d'atomes du nucleïde considéré plutôt qu'à sa concentration.
La loi de vitesse intégrée peut alors s'écrire : \(\mathbf{\ln\frac{N_0}{N}=k.t}\)
dans laquelle \(N_0\) est le nombre d'atomes à l'instant \(t = 0\) et \(N\) le nombre d'atomes restants à l'instant \(t\). Le coefficient de vitesse est alors appelé constante de désintégration.
La vitesse de réaction (nombre de désintégrations par seconde) est appelée activité de la substance radioactive (unité dans le S.I : le becquerel, symbole Bq).
Cliquez ici[4] si vous désirez des précisions sur les unités d'activité radioactive.
Le temps de demi-vie (ou période) est une constante caractéristique de la substance radioactive. Les périodes des éléments radioactifs varient de plusieurs ordres de grandeur.
Par exemple, le polonium 212 a une période de 3,0 x 10-7 s tandis que celle de l'uranium 238 est de 4,5 x 109 ans.