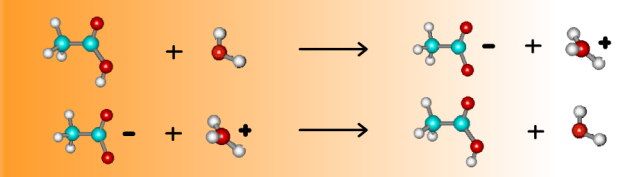
Les processus élémentaires
Rupture homolytique d'une liaison covalente
Les deux électrons de la liaison covalente se partagent entre les deux atomes liés, donnant naissance à deux radicaux libres.
\(\mathbf{\textrm A-\textrm B\to\textrm A^\bullet+\textrm B^\bullet}\)
Ce type de rupture est fréquent en phase gazeuse. Il se produit avec des liaisons non polaires ou peu polaires.
\(\mathbf{\textrm{Br}_2\to2.\textrm{Br}^\bullet}\)
Réaction qui se produit par absorption de rayonnements.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Avec les notations de Lewis la réaction s'écrit :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Rupture hétérolytique d'une liaison covalente
Les deux électrons de la liaison covalente restent sur l'atome le plus électronégatif donnant naissance à deux ions.
\(\mathbf{\textrm A-\textrm B\to\textrm A^-+\textrm B^+}\)
Ce type de rupture est peu fréquent en phase gazeuse, il nécessite une énergie importante.
Cependant il peut se produire sous l'effet de décharges électriques ou de radiations ionisantes (rayons X, particules a ou b ). Il est beaucoup plus fréquent en solution (eau ou autres solvants ionisants \(\textrm{SO}_2\), \(\textrm{HN}_3\))
\(\mathbf{\textrm{CH}_3\textrm{Cl}\to\textrm{CH}_3^++\textrm{Cl}^-}\)
Avec les notations de Lewis la réaction s'écrit :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Un cation dont la charge est portée par un atome de carbone est appelé un carbocation. Notez que l'atome de carbone qui était hybridé en \(\textrm{sp}^3\) dans \(\textrm{CH}_3\textrm{Cl}\) prend une hybridation \(\textrm{sp}^2\) dans le carbocation. Cette rupture constitue la première étape des réactions de substitution nucléophile SN1.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
La deuxième étape étant constitué par l'attaque du carbocation par le réactif nucléophile (voir paragraphe "Formation d'une liaison par transfert d'un doublet dans une lacune électronique" ci-dessous).
Formation d'une liaison covalente par combinaison de deux radicaux
C'est le processus inverse de la rupture homolytique.
\(\mathbf{\textrm A^\bullet + \textrm B^\bullet \to \textrm{A-B}}\)
La formation de la nouvelle liaison est fortement exothermique. Si l'énergie libérée n'est pas évacuée, la liaison nouvellement formée peut se rompre.
Dans le cas de radicaux polyatomiques, l'énergie peut se répartir sur l'ensemble de la molécule puis elle peut être transférée lors d'un choc avec une autre molécule. La combinaison proprement dite des deux radicaux peut être considérée comme bimoléculaire.
\(\mathbf{\textrm{CH}_3^\bullet + \textrm{CH}_3^\bullet \to \textrm{CH}_3\textrm{-CH}_3}\)
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Avec les notations de Lewis la réaction s'écrit :
Dans le cas de radicaux monoatomiques, l'énergie ne peut pas se répartir.
\(\mathbf{\textrm H^\bullet + \textrm{Br}^\bullet \to \textrm{H-Br} \to \textrm H^\bullet + \textrm{Br}^\bullet }\)
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Il faut la participation d'une autre molécule pour absorber une partie de l'énergie libérée et éviter la rupture de la liaison nouvellement formée.
\(\mathbf{\textrm H^\bullet + \textrm{Br}^\bullet + \textrm M \to \textrm{H-Br} + \textrm M}\)
La molécule \(\textrm M\) peut être une molécule quelconque présente dans le milieu. Cette molécule n'apparaît pas dans le schéma de réaction.La réaction est alors considérée comme étant trimoléculaire.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Formation d'une liaison par transfert d'un doublet dans une lacune électronique
Une espèce possédant un doublet libre (non engagé dans une liaison) peut former une liaison grâce à ce doublet avec une espèce possédant une lacune électronique (orbitale non occupée).
Ce type de réaction peut être considéré comme le processus inverse de la rupture hétérolytique.
Ces réactions sont bimoléculaires.
\(\mathbf{\textrm H^+ + \textrm{Cl}^- \to \textrm{H-Cl}}\)
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Avec les notations de Lewis la réaction s'écrit :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Les espèces portant un doublet libre sont des bases de Lewis. En Chimie Organique on les désigne souvent par le qualitatif nucléophile.
Les espèces portant une lacune électronique sont des acides de Lewis. En Chimie Organique on les désigne souvent par le qualitatif d'électrophile.
Ce type de réaction constitue la seconde étape des réactions nucléophiles SN1. La première étape est une réaction monomoléculaire qui forme un carbocation. La seconde voit le nucléophile attaquer le carbocation pour former le produit de substitution.
\(\mathbf{\textrm{HO}^- + \textrm{CH}_3\textrm{-Br} \to \textrm{HO-CH}_3 + \textrm{Br}^-}\)
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Transfert d'un électron (réactions d'oxydo-réduction)
Cet échange peut se faire entre ions de signes opposés ou de même signe, entre molécules neutres, ou entre une espèce chimique et une électrode. L'électrode peut céder un électron ou en capter.
Exemple :
Entre ions de signe contraire :
\(\mathbf{\textrm{SnCl}_3^- + \textrm{Fe}^{3+} \to \textrm{SnCl}_2 + \textrm{FeCl}^{2+}}\)
L'étain passe du nombre d'oxydation +2 à +3 (il est oxydé), tandis que le fer passe de +3 à –2 (il est réduit).
Entre ions de même charge, la réaction est fortement ralentie par la répulsion électrostatique s'exerçant entre les deux ions :
\(\mathbf{\textrm{Fe}^{2+} + \textrm{Ce}^{4+} \to \textrm{Fe}^{3+} + \textrm{Ce}^{3+}}\)
Réaction à une électrode :
\(\mathbf{\textrm{Ag}^+ + \textrm e^- \to \textrm{Ag}}\)
Toutefois, il faut noter que les réactions d'oxydoréduction sont la plupart du temps des réactions complexes, faisant intervenir plusieurs processus élémentaires.
Transfert d'un proton (réactions acido-basiques au sens de Bronstœd)
Lors de l'ionisation d'un acide faible, le proton est tansféré à une molécule d'eau qui joue le rôle de base de Bronstœd :
\(\mathbf{\textrm{R-COOH} + \textrm H_2\textrm O \to \textrm{R-COO}^- + \textrm H_3\textrm O^+}\)
Cette réaction est inversible, on peut donc considérer également le processus inverse, qui est du même type, mais fait intervenir deux ions de signes contraires.
\(\mathbf{\textrm{R-COO}^- + \textrm H_3\textrm O^+ \to \textrm{R-COOH} + \textrm H_2\textrm O}\)
Notez que la stucture du proton hydraté, fait encore l'objet de discussions, on peut également considérer \(\textrm H_5\textrm O_2^+\).
Autre exemple entre un ion et une molécule neutre :
\(\mathbf{\textrm{NH}_3 + \textrm H_3\textrm O^+ \to \textrm{NH}_4^+ + \textrm H_2\textrm O}\)
Transfert direct d'un atome entre deux espèces chimiques
Exemple : Transfert d'atome entre deux molécules
\(\mathbf{\textrm{NO} + \textrm O_3 \to \textrm{NO}_2 + \textrm O_2}\)
Exemple : Transfert d'atome entre une molécule et un radical
\(\mathbf{\textrm{Cl}^\bullet + \textrm H_2 \to \textrm{HCl} + \textrm H^\bullet}\)
Ce type de réaction, qui régénère un autre radical constitue une étape dans la propagation des réactions radicalaires en chaîne. En effet, le radical formé \(\textrm H^\bullet\) peut réagir à son tour sur une molécule de dichlore selon :
\(\mathbf{\textrm H^\bullet + \textrm{Cl}_2 \to \textrm{HCl} + \textrm H^\bullet}\)
Chaque fois que ces deux processus se produisent, ils forment un cycle de propagation dont le bilan est :
\(\mathbf{\textrm H_2 + \textrm{Cl}_2 \to 2. \textrm{HCl}}\)
Redistribution concertée d'électrons
Nous n'avons énuméré ci-dessus que les processus élémentaires les plus simples et les plus fréquents. D'autres processus faisant intervenir des redistributions concertées d'électrons sont également couramment évoqués, notamment en Chimie Organique.
Par exemple la réaction de substitution nucléophile SN2
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Cette réaction fait intervenir une étape bimoléculaire au cours de laquelle la liaison \(\textrm Y-\textrm C\) se forme tandis que la liaison \(\textrm C-\textrm X\) se détruit. On admet la formation d'un état intermédiaire d'énergie plus élevé que celle des réactifs et des produits que l'on appelle complexe activé.
Un autre exemple est celui de la réaction de Diels Alder qui fait intervenir la redistribution de 6 électrons.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Plusieurs mécanismes ont été proposés pour cette réaction qui a une grande importance en synthèse organique.
Sur la base de considérations cinétiques, on penche plutot pour un mécanisme dans lequel la redistribution des électrons s'effectue en une seule étape concertée, bien que non nécessairement parfaitement synchrone.
Remarque :
Ces exemples montrent que la cinétique va bien au delà de l'aspect formel des lois de vitesses pour contribuer à l'établissement d'une description plus fine du mécanisme réactionnel. Celui-ci doit rendre compte non seulement du bilan de la réaction et de ses aspects purement cinétique mais aussi des aspects stéréochimiques, orbitalaires, énergétiques etc...