Approximation dite de l'équilibre rapide
Cette approximation peut s'appliquer lorsqu'il existe des réactions opposées dont les coefficients de vitesse sont sensiblement supérieurs aux coefficients de vitesse des autres réactions.
En effet, on peut alors considérer qu'après quelques instants la concentration des composés qui interviennent dans ces réactions opposées sont celles qui correspondent à un état d'équilibre.Les équations différentielles qui correspondent à ces réactions rapides peuvent alors être remplacées par des équations ordinaires.
Considérons par exemple une réaction de dimérisation de \(\textrm A\) en \(\textrm C\) , qui se déroule en deux étapes :
Une première étape réversible :
\(\mathbf{\mathbf{2.\textrm A \textrm{}^\to_\gets \textrm B}}\)
de coefficient de vitesse \(k_1\) pour la réaction
\(\mathbf{2.\textrm A\to\textrm B}\)
et de coefficient de vitesse \(k_{-1}\) pour la réaction
\(\mathbf{\textrm B\to2.\textrm A}\)
suivie de la transformation
\(\mathbf{\textrm B\to\textrm C}\)
de coefficient de vitesse \(k_2\) .
Cette réaction est bien une réaction complexe selon la définition donnée ci -dessus.
En effet, elle fait intervenir à la fois des réactions opposée
\(\mathbf{2.\textrm A\to\textrm B \textrm{et} \textrm B\to2.\textrm A}\)
et des réactions séries
\(\mathbf{2.\textrm A\to\textrm B \textrm{et} \textrm B\to\textrm C}\)
on peut également considérer que les réactions
\(\mathbf{\textrm B\to2.\textrm A \textrm{et} \textrm B\to\textrm C}\)
constituent des réactions parallèles.
De plus, on remarque que toutes les réactions élémentaires ne sont pas du même ordre.
La réaction
\(\mathbf{2.\textrm A\to\textrm B}\)
est du second ordre
tandis que les réactions sont du premier ordre.
\(\mathbf{\textrm B\to2.\textrm A \textrm{et} \textrm B\to\textrm C}\)
Observons également que l'équation bilan de la réaction est
\(\mathbf{2.\textrm A=\textrm C}\)
En effet, lorsque la réaction est complète le composé \(\textrm B\) sera entièrement transformé en \(\textrm C\). \(\textrm B\) est un intermédiaire réactionnel, qui n'apparaît pas dans l'équation bilan.
Remarque : L'ordre des réactions élémentaires
Dans le schéma proposé, on suppose que les réactions sont des réactions élémentaires. Ceci est indiqué par l'usage d'une flèche dans l'écriture de chaque réaction élémentaire. Or, nous savons que, pour une réaction élémentaire, l'ordre est égal à la molécularité. Il est donc légitime de considérer que :
la réaction
\(\mathbf{2.\textrm A\to\textrm B}\)
bimoléculaire, doit être du second ordre
tandis que les réactions
\(\mathbf{\textrm B\to2.\textrm A}\)
et \(\mathbf{\textrm B\to\textrm C}\)
monomoléculaires, doivent être du premier ordre.
S'il est facile d'écrire le système d'équations différentielles représentatif des lois de vitesse, ce système est difficile à intégrer.
Cliquez ici[1] pour voir les lois de vitesse sous leur forme différentielle.
Si les valeurs des coefficients de vitesse \(k_1\) et \(k_{-1}\) sont toutes deux grandes devant celle de \(k_2\), on peut considérer que l'équilibre \(\mathbf{2.\textrm A \textrm{}^\to_\gets \textrm B}\) s'établit rapidement et se maintient pendant la majeure partie du déroulement de la transformation.
On peut alors écrire :\(K=\frac{C_\textrm B}{C_\textrm A^2}\), \(K\) étant la constante d'équilibre exprimée en concentration. Rappelons que cette constante est égale au rapport des coefficients de vitesse des réactions directes et inverses.
La concentration de \(\textrm B\) peut être tirée de cette expression \(C_\textrm B=K.C_\textrm A^2\)
La vitesse de la transformation \(\mathbf{2.\textrm A=\textrm C}\) peut s'exprimer par la vitesse de formation du produit \(\textrm C\) :
\(\mathbf{\textrm v=\frac{\textrm dC_\textrm C}{\textrm dt}=k_2.C_\textrm B}\)
D'où \(\mathbf{\textrm v=\frac{\textrm dC_\textrm C}{\textrm dt}=k_2.K.C_\textrm A^2}\)
La réaction apparaît donc simplement comme étant du second ordre par rapport à \(\textrm A\).
Le coefficient de vitesse étant égal au produit \(\mathbf{k_2.K}\) soit \(\mathbf{k_2.\frac{k_1}{k_{-1}}}\).
Remarque : Méthodologie
Il résulte de ce qui précède que, si l'approximation de l'équilibre rapide est bien applicable, et qu'on suit l'évolution de la réaction en mesurant la concentration du produit \(\textrm C\) en fonction du temps, on pourra conclure que la réaction obéit à une loi du second ordre par rapport à \(\textrm A\).
L'équation bilan de la réaction étant \(\mathbf{2.\textrm A=\textrm C}\).
\(\textrm B\) est un intermédiaire réactionnel qui n'apparaît pas dans l'équation bilan. Si on n'est pas suffisamment attentif, on pourrait conclure indûment que la réaction est simplement une réaction élémentaire bimoléculaire, l'ordre observé étant égal à sa molécularité.
Cet exemple montre que, bien que l'ordre observé soit égal à la molécularité de la réaction considérée comme élémentaire, cette conclusion serait fausse.
On pourrait s'en rendre compte en mesurant simultanément les concentrations de \(\textrm A\) et de \(\textrm C\) au cours du temps. On observe alors un défaut dans la stœchiométrie, la somme \(C_\textrm A + 2. C_\textrm C\) n'étant pas constante. La différence correspond à la concentration de \(\textrm B\).
Selon les valeurs des constantes \(k_1\) et \(k_{-1}\) cette différence peut être assez faible pour passer inaperçue si les mesures de \(C_\textrm A\) et \(C_\textrm C\) ne sont pas suffisamment précises. La concentration de \(\textrm B\) est alors très faible. Même si on ne peut pas la mesurer, il peut être possible de détecter la présence de \(\textrm B\) dans le milieu par d'autres méthodes analytiques plus sensibles. On dira qu'on a mis en évidence la formation d'un intermédiaire réactionnel (dont on peut déterminer la structure) sans pouvoir mesurer avec précision sa concentration. Dès lors, il est nécessaire de tenir compte de cet intermédiaire dans l'élaboration du mécanisme réactionnel. L'approximation de l'équilibre rapide est notamment utilisée dans la théorie du complexe activée (dans le chapitre "Bases de la théorie, Complexe activé ").
Complément : La théorie du complexe activé
Pour donner une interprétation au niveau moléculaire des réactions bimoléculaires, on considère que les deux molécules forment un complexe d'énergie plus élevée dit complexe activé.
Dans la théorie du complexe activé, on postule que ce dernier est en équilibre rapide avec les réactifs.
On écrit donc : \(\mathbf{K^{\#}=\frac{C_{\textrm{AB}^{\#}}}{C_{\textrm A}.C_{\textrm B}}}\)
La vitesse de transformation est exprimée par la vitesse de formation du produit \(\textrm C\) : \(\mathbf{\textrm v=\frac{\textrm dC_\textrm C}{\textrm dt}=k.C_{\textrm{AB}^\#}=k.K^\#.C_\textrm A.C_\textrm B}\)
La réaction apparaît alors comme étant d'ordre global deux (l'ordre partiel par rapport aux réactifs \(\textrm A\) et \(\textrm B\) étant égal à un).
La théorie du complexe activé repose alors sur le développement de la constante d'équilibre entre le complexe \(\textrm{AB}^\#\) et les réactifs \(\textrm A\) et \(\textrm B\).
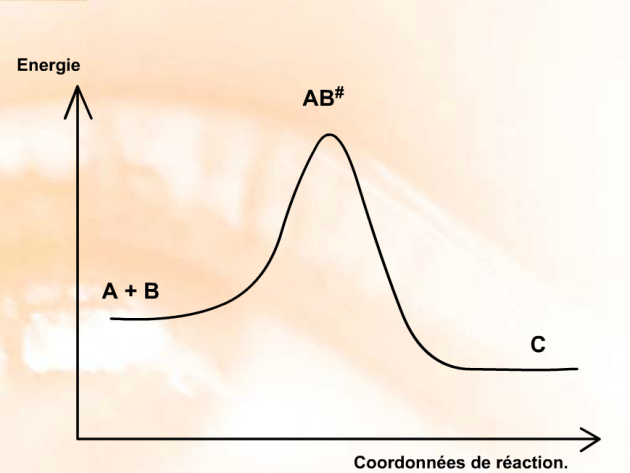
Dans le cadre de cette théorie, le complexe activé \(\textrm{AB}^\#\) n'est pas considéré comme un intermédiaire de réaction car il correspond au maximum sur le diagramme d'énergie en fonction de la cordonnée de réaction. Il s'assimile à un état de transition entre les réactifs et le (ou les) produit(s).
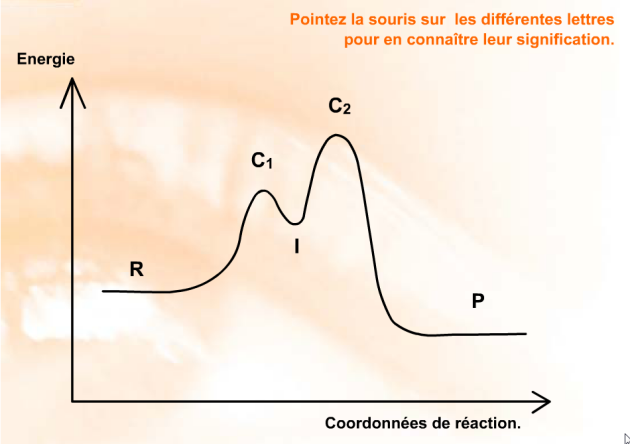
Lorsqu'il y a un véritable intermédiaire réactionnel, il s'agit d'une espèce ayant une certaine stabilité dont l'existence peut être mise en évidence par des méthodes analytiques. Il correspond alors à un minimum le long du diagramme d'énergie. Comme indiqué dans le diagramme suivant :
L'approximation de l'équilibre rapide n'est pas seulement applicable au cas considéré ici \(\mathbf{2.\textrm A \textrm{}^\to_\gets \textrm B\to\textrm C}\) , mais peut être employée pour tout système dans lequel interviennent des réactions opposées dont les coefficients de vitesse sont élevés par rapport aux coefficients de vitesse des autres réactions.