pKa des acides carboxyliques
La polarité des liaisons covalentes est à la base de certaines relations entre la structure d'une molécule et sa réactivité.
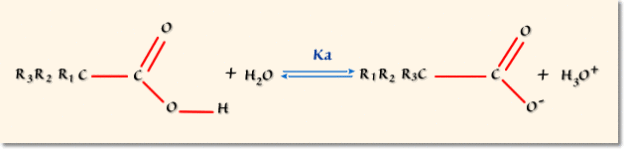
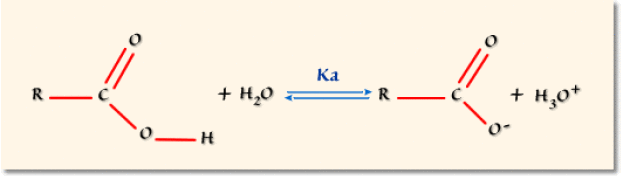
Considérons différents dérivés de l'acide éthanoïque \(\textrm{CH}_3\textrm{COOH}\) (acide acétique). Ces composés en solution aqueuse donnent lieu à un équilibre acido-basique caractérisé par la constante d'équilibre \(K_a\) :
Si \(\textrm R_1\), \(\textrm R_2\) et \(\textrm R_3\) sont des groupements à effet \(-\textrm I\) , la polarité de la liaison \(\textrm O-\textrm H\) de l'acide est amplifiée. L'acide est plus fort et la base conjuguée plus faible.
L'équilibre est alors déplacé vers la formation de l'ion carboxylate. On dit que la charge négative de l'ion carboxylate est stabilisée par effet \(-\textrm I\) . La force relative des couples acide-base est donnée par les valeurs des \(pK_a\) qui rendent compte de l'effet inductif. On donne ci-dessous à titre d'exemple les valeurs des \(pK_a\) pour plusieurs groupements \(\textrm R_1\), \(\textrm R_2\) et \(\textrm R_3\) .
\(\mathrm{R_1}\) | \(\mathrm{R_2}\) | \(\mathrm{R_3}\) | \(\mathrm{R_4}\) |
H | H | H | 4,74 |
Cl | H | H | 2,86 |
Cl | Cl | H | 1,26 |
Cl | Cl | Cl | 0,64 |
F | F | F | 0,23 |
Si le substituant à l'origine de la polarisation est à plusieurs liaisons du site acide, son effet se fait moins sentir et l'acidité décroit. Dans le tableau suivant, on donne ainsi le \(pK_a\) pour divers substituants monochlorés qui se distinguent par la position du chlore par rapport au site acide.
R | \(\mathrm{pK_A}\) |
\(\mathrm{CH_3-CH_2-CH_2-}\) | 4,9 |
\(\mathrm{ClCH_2-CH_2-CH_2-}\) | 4,5 |
\(\mathrm{CH_3-CHCl-CH_2-}\) | 4,1 |
\(\mathrm{CH_3-CH_2-CHCl-}\) | 3,8 |
Le groupement dont l'effet inductif \(-\textrm I\) est celui qui comporte l'atome de chlore le plus proche de la fonction acide. Il exhalte l'acidité de la molécule.