Formules limites - Systèmes simples
Une molécule comportant des électrons délocalisés (\(\pi\) et/ou non liant) peut être décrite par un ensemble de formules de Lewis dans lesquelles les électrons sont tous localisés. Ces formules de Lewis appelées formules limites ou formules mésomères décrivent le même enchaînement d'atomes dont la position est fixée par le squelette de liaisons \(\sigma\).
Ces formules limites sont fictives, elles ne représentent pas une espèce existante. La formule réelle est un hybride de résonance de l'ensemble des formules limites, chacune d'elle contribuant avec un certain poids.
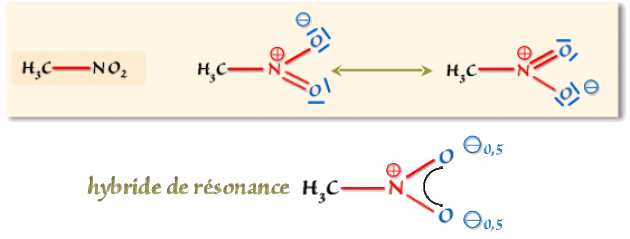
Le groupe nitro :
L'expérience permet de déterminer que les longueurs de liaison \(\textrm{NO}\) sont identiques, soit 0,121 nm, intermédiaires entre \(\textrm N-\textrm O\) (0,146 nm) et \(\textrm N=\textrm O\) (0,114 nm) et le moment dipolaire du nitrométhane est de 3,10 D. Pour en rendre compte, il faut donc une description équivalente des deux liaisons \(\textrm N-\textrm O\) et faire apparaître la polarisation de ces liaisons.
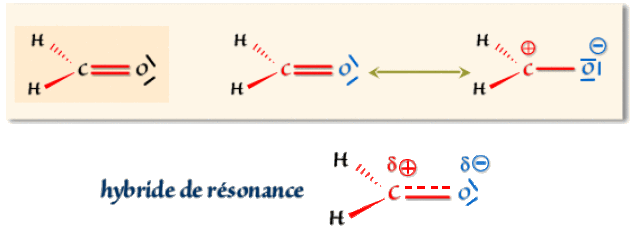
Le groupe carbonyle :
Dans cette molécule électriquement neutre, le moment dipolaire de 2,3 D indique que l'oxygène possède un excès d'électrons. La formule de Lewis classique ne suffit donc pas et il faut admettre une résonance avec une formule ionique dans laquelle l'oxygène prends une charge -1 et le carbone une charge +1, la molécule devant rester électriquement neutre.