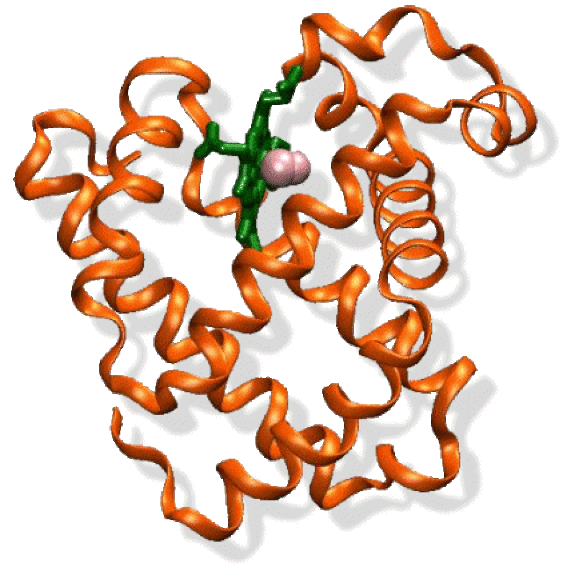Le fer : Applications
C'est le métal le moins coûteux. Il est rarement employé à l'état pur, car il se corrode facilement. C'est également le métal le plus utile sous forme d'acier. L'acier est obtenu à partir de la fonte liquide. Cet acier carboné renferme au maximum 2 % de carbone. Existe également l'acier allié où d'autres éléments métalliques sont incorporés lors de son élaboration afin d'en modifier les propriétés. Selon la teneur de l'acier en carbone, on obtient un matériau doux malléable et ductile pour des teneurs inférieures à 0,2 % de carbone, demi-dur ou extra-dur pour des teneurs plus élevées. En fonction de leur dureté, ils sont choisis comme matériaux pour outillages ou de construction. Aujourd'hui, les aciers de construction sont généralement des aciers alliés qui peuvent répondre à des sollicitations mécaniques plus élevées que les aciers carbonés. Les aciers inoxydables sont des aciers alliés contenant des pourcentages élevées de chrome et de nickel, leur assurant une bonne résistance à la corrosion.

En plus de son intérêt technologique, le fer est nécessaire à toute vie humaine et animale, notamment en assurant le transport de l'oxygène dans le sang sous forme de myoglobine et d'hémoglobine. On le trouve aussi dans les cytochromes qui transportent les électrons dans les chaînes respiratoires et dans certaines enzymes. Dans un humain de 60 kilogrammes, on trouve 4 grammes de fer, dont 2,5 grammes correspondent à l'hémoglobine. Une déficience en fer provoque des anémies, tandis qu'un excès de fer provoque des maladies du foie et des reins. L'hémoglobine a une structure complexe constituée de quatre chaînes protéiniques et de quatre hèmes. Un hème est un complexe de fer à l'état divalent, lié à une porphyrine (molécule plane) et en position apicale à une histidine elle-même liée à la protéine. L'ion Fe(II) qui aime les coordinences 6, possède donc un site de coordination libre en position apicale. Ce site est susceptible de fixer de manière réversible l'oxygène. Sa fonction de transporteur d'oxygène peut être altérée dans certaines conditions pathologiques. Par exemple, l'affinité de cette molécule pour le monoxyde de carbone est plus grande que pour \(\textrm O_2\), d'où la gravité des intoxications à \(\textrm{CO}\) (cf. figure ci-dessous).