Rappel introductif sur la liaison chimique dans les complexes
Deux grands types de liaisons chimiques peuvent être considérés.
La liaison chimique mettant en jeu des électrons.
Lorsque la liaison chimique est basée sur la mise en commun d'électrons, les électrons mis en jeu sont les électrons présents dans les orbitales les plus externes. Trois grands sous groupes de liaison chimique peuvent être alors considérés :
La liaison covalente (homopolaire) : Dans ce cas de figure, les deux atomes liés par covalence sont identiques, le doublet électronique que les atomes ont en commun est partagé entre eux de façon identique.
Exemple : \(\textrm C-\textrm C\) dans le diamant.
La liaison ionique (hétéropolaire) : Les deux atomes ne sont pas les mêmes, l'un est toujours plus électronégatif que l'autre, et il attire plus fortement le doublet électronique. Dans ce cas, on parle de liaison ionique ou de liaison covalente polarisée.
Exemple : \(\textrm{Na}-\textrm{Cl}\) du sel de cuisine.
La liaison métallique : Ce mode de liaison des atomes de métal est d'un type particulier. Il relève du même principe de base que la covalence : la mise en commun d'électrons. Cependant, ce mode de liaison repose sur l'idée de la mise en commun de tous les électrons de valence entre tous les atomes de l'échantillon de métal quel que soit son volume. C'est une extension de la notion de covalence.
Exemple : \(\textrm{Cu}^+-\textrm{Cu}^+\) dans le cuivre.
La liaison chimique ne mettant pas en jeu des électrons.
Ce sont des liaisons de type électrostatique ou de type Van der Waals. Certaines molécules sont polaires ; elles sont constituées de liaisons polarisées. Par exemple, si l'on considère la molécule d'eau, \(\textrm H_2\textrm O\) : elle est constituée d'un atome d'oxygène plus électronégatif que les atomes d'hydrogène. Par conséquent, bien qu'elle soit électriquement neutre dans sa globalité, la molécule présente une extrémité chargée positivement et une autre chargée négativement, de sorte qu'il s'agit d'une molécule polaire. Les molécules polaires s'attirent mutuellement et cette attraction est appelée une attraction dipôle-dipôle.
Exemple : La liaison hydrogène entre molécules d'eau
Ex : \(\textrm O^{-\delta} ......\textrm H^{+\delta} - \textrm{OH}\), la liaison hydrogène entre molécules d'eau.
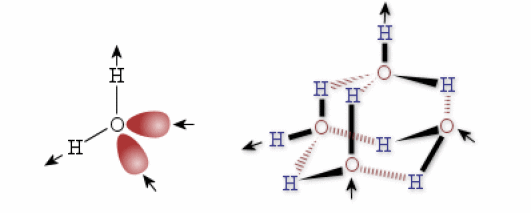
Figure a :
Schéma représentant : à gauche, une molécule d'eau. Chaque molécule d'eau joue à la fois le rôle de donneur de liaison H grâce à ses deux liaisons O-H et d'accepteur de liaison H grâce à ses deux doublets non liants sur l'atome O ; à droite, un réseau de liaisons hydrogène entre plusieurs molécules d'eau.
Les associations dipôle-dipôle ont souvent lieu par l'intermédiaire d'un atome d'hydrogène, d'où le nom de liaison hydrogène que l'on donne à ce type d'interaction.
Dans les composés de coordination, espèces dans lesquelles divers anions ou molécules neutres (\(\textrm H_2\textrm O\), \(\textrm{NH}_3\), ...) se lient à un atome ou à un ion d'un métal de transition (\(\textrm{Cu}^{2+}\), \(\textrm{Fe}^{3+}\), ...), la formation de la liaison se réalise de façon singulière.
La liaison se forme par mise en commun d'électrons selon le modèle type « Réaction Acide-Base » de Lewis. Les liaisons entre l'ion métallique central et les ligands (ou coordinats) résultent de la mise en commun d'un doublet libre apporté par le ligand, en utilisant une case vide de l'ion central. Le métal (ou l'ion) de transition agit donc en tant qu'acide de Lewis, alors que le ligand est une base de Lewis caractérisée par un doublet d'électrons. La caractéristique de tous les ligands est donc de posséder au moins un doublet libre (non liant).
Trois grandes approches permettent de décrire plus en détail cette liaison « métal-ligand » dans les composés de coordination :
l'approche de la liaison de valence,
celle du champ cristallin,
celle des orbitales moléculaires.
Pour chacune de ces approches, la notion de symétrie de l'environnement de l'ion de transition est un facteur important. En effet, l'appellation « COMPLEXES » pour les composés de coordination est venue du fait qu'ils ne satisfaisaient pas à la notion classique de « VALENCE ».