Introduction
L'approche de la liaison de valence repose sur deux points essentiels :
La formation de la liaison chimique résulte toujours d'une réaction « acide-base » de type Lewis selon le schéma .
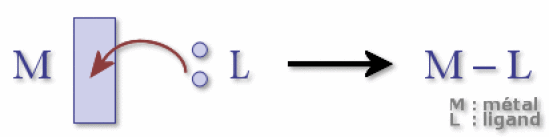
La symétrie de l'environnement (coordination) est un facteur important. Elle doit prendre en compte deux facteurs : la notion d'orbitales \(\textrm d\) aptes à participer à une liaison chimique selon Lewis (orbitale \(\textrm d\) vacante) et le nombre d'orbitales \(\textrm d\) qui doit correspondre à la coordination.
L'adéquation entre ces deux facteurs n'est pas évidente, notamment lorsque les liaisons chimiques doivent être identiques et que le nombre d'orbitales vacantes n'est pas suffisant. Une solution à cette difficulté est apportée par la méthode de l'hybridation des orbitales atomiques.