Cas de la symétrie octaédrique de l'environnement de coordinats
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Dans le cas d'un environnement octaédrique de l'ion métallique, les lobes \(d_{x^2 - y^2}\) et des orbitales et centrés le long des axes \(\textrm O_x\), \(\textrm O_y\), \(\textrm O_z\) pointent vers les coordinats.
En revanche les lobes \(d_{xy}\), \(d_{xz}\), \(d_{yz}\) centrés le long des bissectrices des angles \(x\textrm Oy\), \(y\textrm Oz\), \(z\textrm Ox\) pointent entre les coordinats.
Exemple :
Question : si l'on admet que l'ion de transition renferme uniquement 1 seul électron \(d\) (\(d^1\)), dans quel type d'orbitales (\(d_{xy}\), \(d_{xz}\), \(d_{yz}\)) ou (\(d_{x^2-y^2}\) et \(d_{z^2}\)) va se positionner cet électron ?
Les coordinats étant considérés pour cet électron comme des centres chargés négativement, le peuplement des orbitales \(d\) va être gouverné par la minimisation des répulsions électrostatiques. Les lobes des orbitales \(d_{xy}\), \(d_{xz}\), \(d_{yz}\) étant plus éloignés des coordinats que ceux des orbitales \(d_{x^2-y^2}\) et \(d_{z^2}\) il s'ensuit que si l'électron occupe une des trois orbitales (\(d_{xy}\), \(d_{xz}\), \(d_{yz}\)) les répulsions électrostatiques seront minimisées.
L'électron, en se plaçant dans l'une de ces trois orbitales (qui sont parfaitement identiques d'un point de vue symétrie), va minimiser son énergie. Ceci revient à considérer que les trois orbitales \(d_{xy}\), \(d_{xz}\) et \(d_{yz}\) , et sont de plus basse énergie que les orbitales et \(d_{x^2-y^2}\) et \(d_{z^2}\).
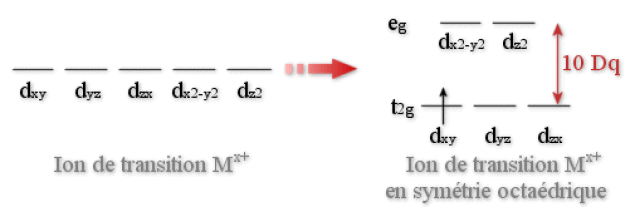
La présence des six ligands en symétrie octaèdrique provoque ainsi un écart énergétique 10 Dq entre les orbitales \(e_g\) et \(t_{2g}\).