Cas de la symétrie tétraédrique de l'environnement de coordinats
Considérons à présent le cas d'un environnement de coordinats tétraèdrique. Un tétraèdre peut toujours être inscrit dans un cube.
Exemple :
Comment positionner les lobes des deux types d'orbitales \(\textrm d\) ?
Les lobes des orbitales \(\textrm d_{\textrm x^2 - \textrm y^2}\) et \(\textrm d_{\textrm z^2}\) pointent vers le milieu des faces du cube. En revanche les lobes des orbitales \(\textrm d_{\textrm{xy}}\), \(\textrm d_{\textrm{xz}}\) et \(\textrm d_{\textrm{yz}}\) pointent vers le milieu des arêtes.
Exemple :
Comme précédemment (dans le cas d'un environnement octaédrique), si l'on considère que l'ion de transition a une population électronique , dans quel type d'orbitales cet électron va se positionner ?
L'électron ira dans la région de l'espace (lobes des orbitales) où l'énergie de répulsion électrostatique sera minimisée.
Les lobes les plus éloignés des coordinats sont ceux correspondant aux orbitales \(\textrm d_{\textrm x^2 -\textrm y^2}\) et \(\textrm d_{\textrm z^2}\) (pointant vers le centre des faces) alors que ceux des orbitales \(\textrm d_{\textrm{xy}}\), \(\textrm d_{\textrm{xz}}\) et \(\textrm d_{\textrm{yz}}\) pointent vers le milieu des arêtes.
Le diagramme d'énergie des orbitales \(\textrm d\) en symétrie tétraédrique est donné à la figure suivante.
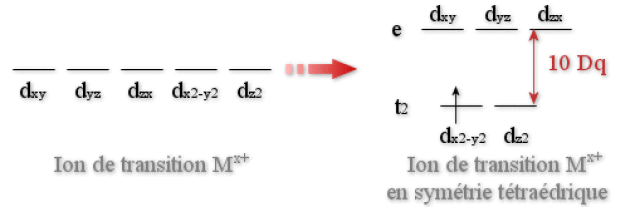
Diagramme d'énergie des orbitales d pour un ion de transition dans un environnement tétraédrique (10 Dq = différence d'énergie entre les deux groupes d'orbitales \(\mathrm{t_2}\) et e).
Remarque :
Dans le cas de l'environnement tétraédrique de coordinats, aucun des lobes des orbitales \(\textrm d\) ne pointent dans la direction des coordinats. Il en découle que les forces de répulsion électrostatiques électron/coordinats seront plus faibles que dans le cas d'un environnement octaédrique (où les lobes des orbitales \(\textrm d_{\textrm x^2 - \textrm y^2}\) et \(\textrm d_{\textrm z^2}\) sont dirigés directement vers les coordinats). Il s'ensuit que l'éclatement énergétique entre les deux groupes d'orbitales (notés \(t_2\) et \(e\) pour les différencier du cas de l'environnement octaédrique) sera plus faible.
Par exemple, pour un même ion de transition et des coordinats identiques :
\(10\textrm{ Dq}_\textrm{(tetra)}\approx\frac{4}{9} 10\textrm{ Dq}_\textrm{(octa)}\)
(tétra = environnement tétraédrique, octa = environnement octaédrique)