Configurations électroniques champ faible et champ fort
Selon la valeur de l'énergie du champ cristallin (10 Dq), un ion métallique en symétrie octaèdrique peut adopter deux configurations électroniques différentes respectant l'une et l'autre les considérations suivantes :
soit les électrons peuvent peupler l'ensemble des orbitales \(\textrm t_{2\textrm g}\) et \(\textrm e_\textrm g\). Dans ce cas la règle de Hund est respectée mais les électrons « payent un prix » pour aller se loger dans les orbitales \(\textrm e_\textrm g\) plus hautes en énergie de 10 Dq que les orbitales \(\textrm t_{2\textrm g}\).
soit la valeur de 10 Dq est très élevée et uniquement les orbitales de type \(\textrm t_{2\textrm g}\) pourront être peuplées. Dans ce cas, le « prix » à payer est lié au fait que les électrons doivent s'apparier dans une même orbitale. Un électron doit entrer dans une orbitale avec un spin antiparallèle à celui de l'électron déjà présent.
Ainsi, deux répartitions des électrons dans les orbitales \(\textrm d\) peuvent être envisagées (un exemple est donné pour un ion \(\textrm d^5\) dans la figure ci-dessous). Elles correspondent à deux configurations électroniques différentes :
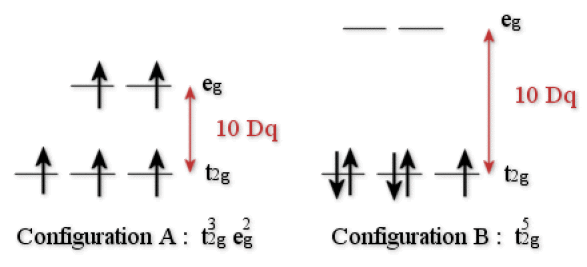
Représentation de deux configurations électroniques d'un ion \(\mathrm{d^5}\) (par exemple Mn(II)) selon que la valeur de 10 Dq est faible (cas A) ou forte (cas B)
Ainsi, deux configurations électroniques sont possibles et appelées configuration champ faible (\(\textrm A\)) ou configuration champ fort (\(\textrm B\)).