Energie de Stabilisation du Champ Cristallin (ESCC)
A chaque configuration électronique, on peut associer une énergie de stabilisation du champ cristallin (ESCC). Elle correspond au gain ou à la perte d'énergie de l'ion en symétrie octaèdrique par rapport à la symétrie sphérique.
En règle générale, un complexe métallique adoptera toujours la configuration de plus basse énergie. Comment évaluer l'énergie de stabilisation du champ cristallin ?
Par exemple, prenons un complexe en symétrie octaèdrique, il adopte le schéma énergétique suivant :
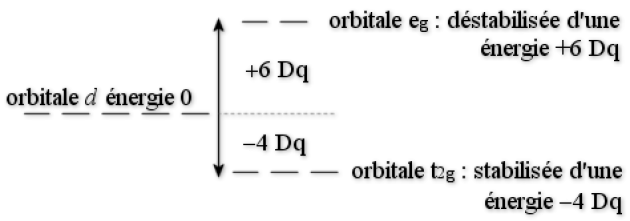
Dans un complexe sphérique, l'énergie des orbitales \(\textrm d\) est prise comme zéro d'énergie. Dans un complexe à symétrie octaèdrique, le jeu des orbitales \(\textrm t_{2\textrm g}\) est plus bas en énergie de 4 Dq ; quant au jeu des orbitales \(\textrm e_\textrm g\), il est plus haut de 6 Dq.
Dans une tel complexe, si les électrons sont forcés de s'apparier dans une même orbitale, l'énergie de stabilisation du champ cristallin sera altérée par l'énergie d'appariement \(\textrm P\) des électrons.
Pour la configuration \(t_{2g}^\textrm x \textrm e_\textrm g^\textrm y\) possédant \(\textrm p\) paires d'électrons appariés, on calcule l'énergie de stabilisation du champ cristallin ESCC selon :
\(\textrm{ESCC} = (- 4\textrm{ Dq}). x + (+6\textrm{ Dq}). y + \textrm p\textrm P\)
Elle correspond au gain ou à la perte d'énergie de l'ion en symétrie octaédrique par rapport à la symétrie sphérique.
Exemple : L'ion Cr3+
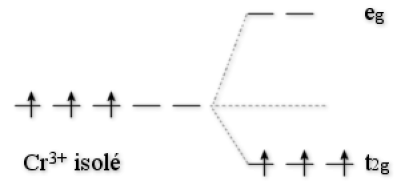
\(\textrm{ESCC} = -4\textrm{ Dq}. 3 = -12\textrm{ Dq}\), l'ion \(\textrm{Cr}^{3+}\) est plus stable en symétrie octaédrique d'une quantité de par rapport à la symétrie sphérique.
Exemple : L'ion Co3+
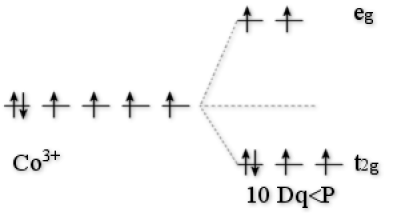
\(\textrm{ESCC}=-4\textrm{ Dq}+\textrm P\)
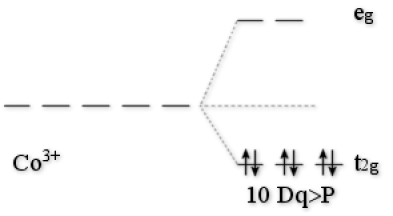
\(\textrm{ESCC}=-24\textrm{ Dq}+3.\textrm P\)
Exemple : L'ion Fe3+
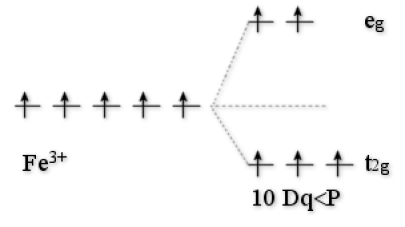
\(\textrm{ESCC}=0\)
Ainsi les complexes dans lesquels les électrons \(\textrm d\) du métal s'apparient plutôt que de lutter contre le champ électrique fort des ligands, sont appelés complexes à champ fort. En revanche, les complexes dans lesquels les électrons peuvent plus facilement vaincre 10 Dq, sont appelés complexes à champ faible. Les deux types de complexes sont courants pour les éléments de transition ayant des électrons de valence \(3\textrm d\). Presque tous les complexes des éléments ayant des orbitales \(4\textrm d\) et \(5\textrm d\) sont des complexes à champ fort.