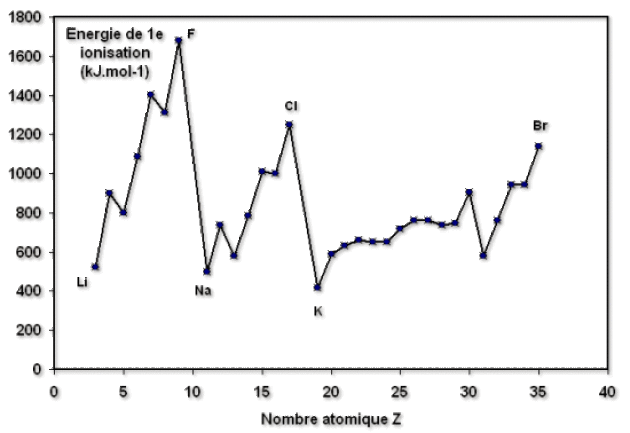
Potentiel d'ionisation
Ce potentiel, noté \(EI_i\), caractérise l'énergie nécessaire pour arracher le \(i\)–ème électron à l'atome neutre dans l'état gaz. L'énergie de première ionisation (correspondant à \(i = 1\)) permet de comparer l'aptitude de différents atomes à s'ioniser.
Dans une même période \(EI_i\) augmente avec \(Z\) du fait de la plus grande attraction exercée par le noyau ( \(r_A\) diminue et l'énergie varie comme l'inverse du rayon).
En revanche, dans une même colonne (ou groupe), l'augmentation du rayon de l'atome, en affaiblissant l'attraction exercée sur les électrons de valence, entraîne une diminution de \(EI_i\) quand \(Z\) augmente.