Structure
La nature de la liaison entre atomes appartenant aux colonnes 14 à 17 varie de covalente dans le cas des éléments les plus électronégatifs à métallique dans le cas des éléments les plus lourds et les moins électronégatifs.
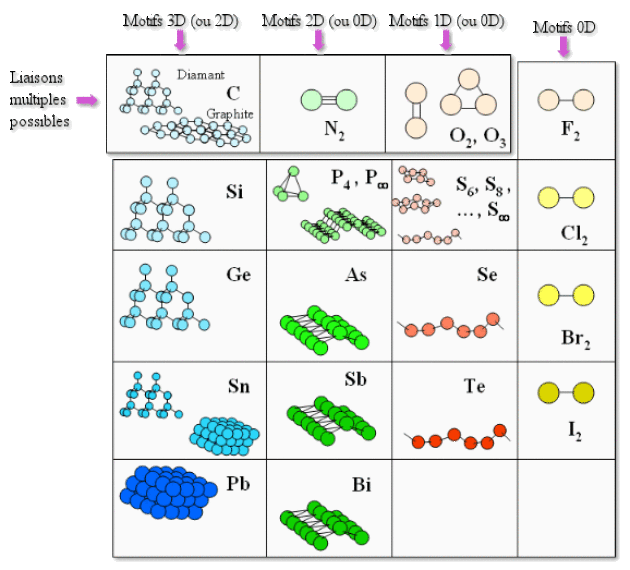
La tendance générale pour ces atomes est de former des liaisons étendues constituant des réseaux (phénomène de caténation). Cependant la formation d'un réseau tridimensionnel stable suppose que l'élément possède autant d'électrons de valence que d'orbitales atomiques.
Ceci explique l'existence sous forme de réseaux 3D covalents (structure diamant) des éléments de la colonne 14 de configuration électronique \(np^4\) (\(\textrm C\), \(\textrm{Si}\), \(\textrm{Ge}\), \(\textrm{Sn}\)), qui peuvent être tétravalents. Ces corps simples, solides à température ordinaire, possèdent alors des températures de fusion élevées.
Leur configuration électronique ne permet pas aux éléments des colonnes 15 (trivalents) et 16 (divalents) de constituer de tels réseaux 3D. Pour cette raison, ces corps simples, solides à température et pression ordinaires, se caractérisent par des réseaux 2D (feuillets) comme on peut l'observer dans le cas de \(\textrm{As}\), \(\textrm{Sb}\), \(\textrm{Bi}\), (voir tableau ci-dessus), 1D (chaînes de \(\textrm S\), \(\textrm{Se}\), \(\textrm{Te}\)) ou d'entités polymériques \(\textrm X_n\) (\(\textrm{As}_4\), \(\textrm P_4\), \(\textrm S_6\), \(\textrm S_8\), \(\textrm S_{20}\)) (voir tableau ci-dessus). Très souvent d'ailleurs ces corps purs existent sous plusieurs variétés polymorphiques comme dans le cas du soufre qui existe sous formes polymériques \(\textrm S_n\) avec \(n=2\textrm,6\textrm,8\textrm,10\textrm,\textrm{.....} 20\)- mais aussi sous forme de chaînes monodimensionnelles \(\textrm S_\infty\) (c'est le soufre mou) (voir tableau ci-dessus). Cette aptitude à former des chaînes est d'ailleurs mise à profit pour la vulcanisation des polymères.
Il va de soi que les liaisons entre feuillets, chaînes ou motifs polymériques étant faibles ,ces solides possèdent des températures de changement d'état qui diminuent avec la dimensionnalité et l'augmentation du caractère métallique (voir tableau 1 de l'introduction).
La possibilité de recouvrement des orbitales \(2p\) pour former des liaisons \(\pi\) très stables singularisent les éléments de la 2ème période : \(\textrm C\), \(\textrm N\) et \(\textrm O\) qui peuvent exister sous forme de feuillets (structure graphite du carbone) ou de molécules comme \(\textrm O_2\), \(\textrm O_3\), ou \(\textrm N_2\).
Dans le cas du fluor et des halogènes de configuration électronique \(np^5\), la seule possibilité est la formation de liaisons \(\sigma\) conduisant à des molécules \(\textrm X_2\). La cohésion entre molécules est assurée par des forces de type London généralement faibles mais qui croissent rapidement avec la polarisabilité de la molécule - c'est-à-dire avec sa taille et donc le numéro atomique \(Z\). En conséquence, on voit que les températures de changement d'états des dihalogènes augmentent nettement avec \(Z\) ( voir au tableau 1 de l'introduction).