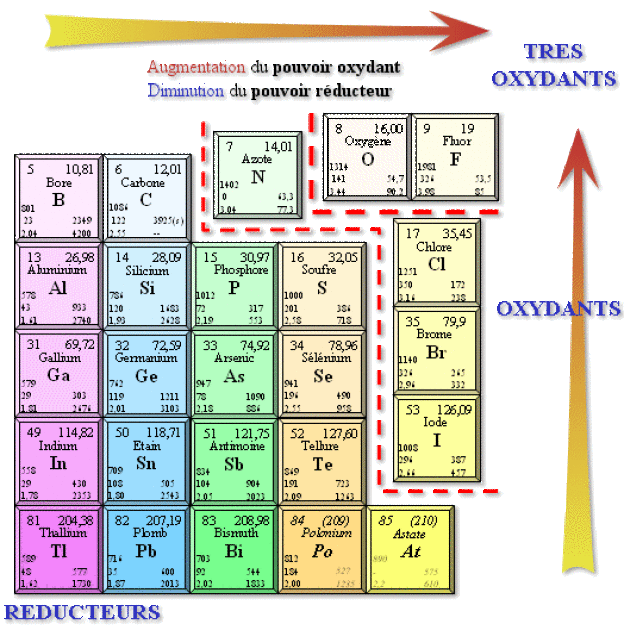
Propriétés chimiques
La valeur élevée de l'électronégativité confère à ces éléments des propriétés oxydantes. C'est la possibilité, pour ces éléments, de posséder des degrés d'oxydation négatifs, c'est-à-dire de gagner des électrons, éventuellement jusqu'à la complétion de la sous-couche \(np\) à 6 électrons. Cette possibilité se limite en fait aux éléments les plus électronégatifs comme l'azote, l'oxygène et le soufre, ainsi que les halogènes, qui peuvent exister respectivement aux degrés d'oxydation \(\textrm{-III}\), \(\textrm{-II}\) ou \(\textrm{-I}\).
Egalement, les éléments constituant le bloc \(p\) - à l'exception de l'oxygène et du fluor - peuvent prendre tous les nombres d'oxydation positifs correspondant à la perte totale de leurs électrons de valence, soit \(+(2 + x)\) pour \(x\) électrons \(p\). On a par exemple +5 pour \(\textrm N\), +6 pour \(\textrm S\). Toutefois, en même temps que \(Z\) augmente, on observe la stabilité croissante des degrés d'oxydation n'impliquant pas les électrons \(s\), d'où la stabilité des ions \(\textrm{Tl}^+\),\( \textrm{Bi }^{3+}\), \(\textrm{Sn}^{2+}\), et \(\textrm{Pb}^{2+}\). Ce don d'électron est un caractère réducteur.
On doit cependant toujours conserver à l'esprit que la taille d'un anion augmentant avec la charge et le numéro atomique \(Z\), celui-ci devient alors aisément polarisable (cas des ions nitrures \(\textrm N^-\), séléniures \(\textrm{Se}^{2-}\), iodures \(\textrm I^-\), par exemple). De même, lorsque la charge du cation augmente ce dernier devient petit et fortement polarisant (cas de \(\textrm{Sn}^{4+}\), \(\textrm{As}^{5+}\), \(\textrm{Se}^{4+}\)). Dans les deux cas, la liaison présentera un certain caractère covalent.