Les oxydes d'éléments p
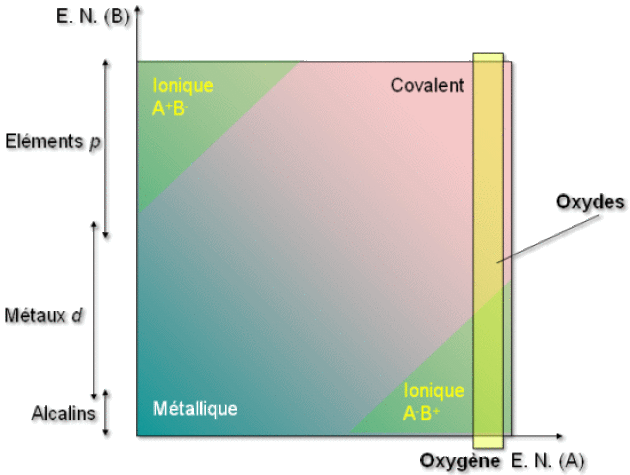
L'oxygène est un des éléments les plus électronégatifs qui soient, donc dans ses combinaisons on trouvera essentiellement des liaisons covalentes et ioniques.
Du fait de la faible différence d'électronégativité existant entre l'atome d'oxygène et l'élément \(p\) on a donc le plus souvent formation d'un oxyde de type covalent excepté dans le cas des éléments lourds et peu électronégatifs qui possèdent un certain caractère métallique et donc les oxydes présenteront un caractère ionique marqué.
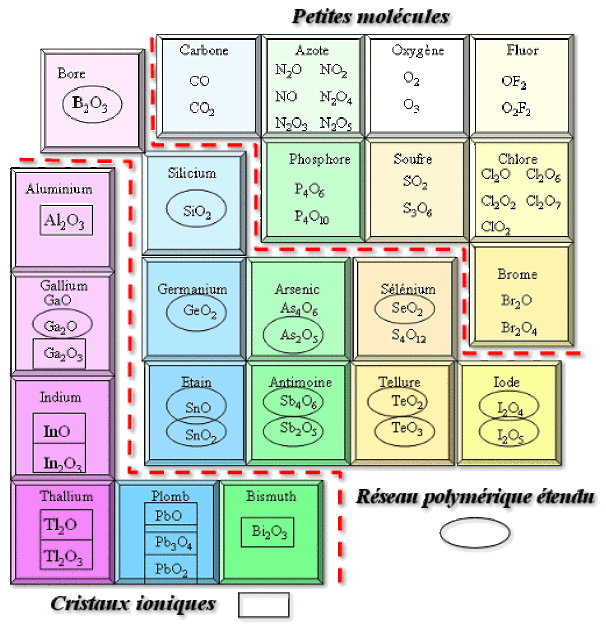
De manière tout à fait analogue à ce que nous avons décrit lors de l'étude des corps purs, l'oxygène, dans ses combinaisons avec les autres éléments, est susceptible de former des liaisons simples ou multiples avec les éléments de la 2ème période et avec le chlore, conduisant à la formation d'oxydes moléculaires. Ces oxydes sont le plus souvent gazeux à température ordinaire et leur géométrie peut-être prévue à l'aide de la théorie VSEPR.
Avec les autre éléments, on obtiendra des oxydes constitués de petits polymères comme par exemple \(\textrm P_4\textrm O_{10}\), \(\textrm{SO}_3\), \(\textrm{SeO}_3\) (tableau ci-dessous), ou des oxydes constitués de réseaux polymériques étendus formant des chaînes (1D), feuillets (2D) ou réseaux (3D) comme \(\textrm{SiO}_2\), \(\textrm{GeO}_2\), \(\textrm{SnO}\), \(\textrm{SnO}_2\), \(\textrm{PbO}\), \(\textrm{PbO}_2\), \(\textrm{Sb}_2\textrm O_3\), \(\textrm{Bi}_2\textrm O_3\).
Ces oxydes sont alors généralement solides à température ordinaire et peuvent même dans le cas de la formation de réseaux covalents- comme \(\textrm{SiO}_2\)- posséder des températures de fusion élevées.
Ces oxydes, et plus particulièrement les oxydes moléculaires, sont généralement de type acide : c'est-à-dire que le \(\textrm{pH}\) de la solution devient acide lorsqu'ils sont dissous dans l'eau, ou alors qu'ils sont solubles en milieu basique. Le caractère acide diminue en même temps que le caractère ionique de la liaison augmente de sorte que certains oxydes tels \(\textrm{PbO}_2\) ou \(\textrm{SnO}_2\) présentent un caractère amphotère.
Toutes ces propriétés seront reprises en détail dans la ressource dédiée à l'étude de l'oxygène.