L'atome d'azote
Il existe sous deux isotopes : \(\textrm{}^{14}_{ 7}\textrm N\) (99,7 %)et \(\textrm{}^{15}_{ 7}\textrm N\) (0,3 %).
Sa structure électronique est : \(1\textrm s^2{} 2\textrm s^2{} 2\textrm p^3\) : il y a 5 électrons de valence.
Le degré d'oxydation maximum est donc \(\textrm{+V}\), et le degré d'oxydation minimum est \(\textrm{-III}\). Le degré \(\textrm{+III}\) est assez courant, mais d'autres sont possibles (+I, +II, +IV).
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Son électronégativité est de 3,0 sur l'échelle de Pauling : c'est la quatrième de toute la classification, après \(\textrm F\), \(\textrm O\) et \(\textrm{Cl}\).
Complément : Electronégativités dans la classification périodique
Cette grandeur sans unité caractérise l'aptitude d'un élément à attirer les électrons lors d'une mise en liaison avec un atome de nature différente. Elle est d'autant plus importante que les valeurs de l'affinité électronique et surtout de l'énergie de première ionisation sont élevées.
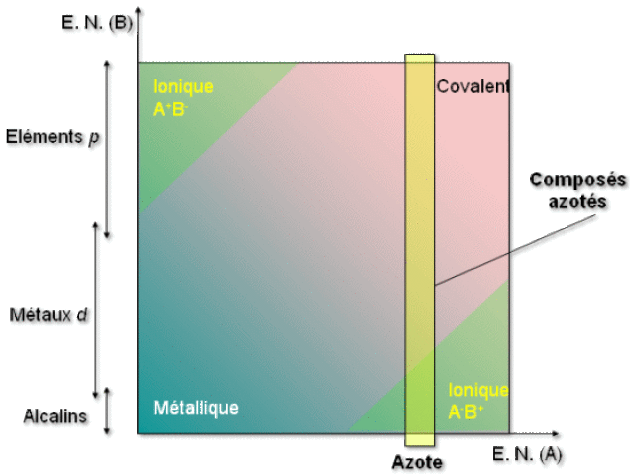
Par conséquent, les composés de degré d'oxydation positif seront essentiellement covalents, car il présente une faible différence d'électronégativité avec les éléments plus électronégatifs que lui.
En revanche, les composés de degré d'oxydation négatif pourront avoir un caractère ionique plus nettement marqué. Il est toutefois difficile d'aller vers l'ion \(\textrm N^{3-}\), sauf avec des éléments très électropositifs (alcalins, etc.)
Complément : Le caractère iono-covalent de la liaison chimique
La liaison métallique, basée sur la délocalisation des électrons, ne peut être dominante que si les éléments ont une faible électronégativité, c'est-à-dire une faible tendance à localiser les électrons dans les liaisons.
La liaison covalente, basée sur la localisation des électrons entre les atomes, est prédominante entre atomes fortement électronégatifs.
La liaison ionique est obtenue pour une forte différence d'électronégativité.
Les composés de l'azote sont donc :
des molécules covalentes (comme l'ammoniac),
des solides ioniques ou covalents (comme les nitrures de lithium, ionique, et de silicium, covalent et réfractaire),
des solides partiellement métalliques (composés d'insertion).
Les énergies d'ionisation sont les suivantes :
Première ionisation | \(\mathrm{N(g)\to N^+(g)+e^-}\) | \(\Delta H_{\mathrm{ion}}(\mathrm{I)=15 eV}\) |
Deuxième ionisation | \(\mathrm{N^+(g)\to N^{2+}(g)+e^-}\) | \(\Delta H_{\mathrm{ion}}(\mathrm{II)=30 eV}\) |
Troisième ionisation | \(\mathrm{N^{2+}(g)\to N^{3+}(g)+e^-}\) | \(\Delta H_{\mathrm{ion}}(\mathrm{III)=50 eV}\) |
Il est donc très coûteux en énergie d'obtenir \(\textrm N^{3+}\textrm{(g)}\).