L'hydrazine
Structure de la molécule
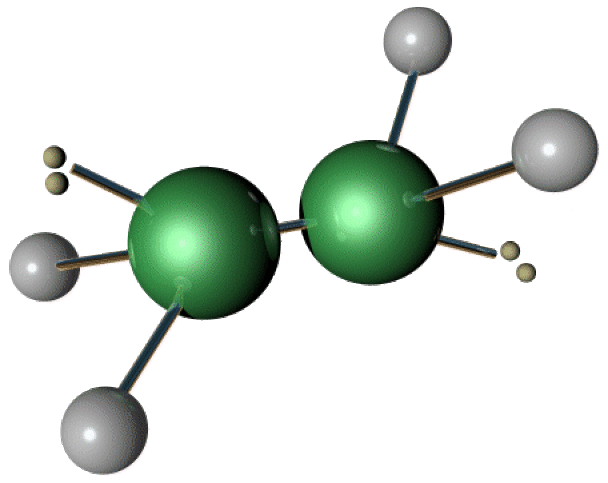
On voit aisément que l'hydrazine est à l'ammoniac ce que l'éthane est au méthane : c'est le deuxième de la série des composés hydrogénés, et le premier avec une liaison simple \(\textrm N-\textrm N\). Il y a donc des analogies avec \(\textrm{NH}_3\), et des spécificités liées à la liaison \(\textrm N-\textrm N\).
Préparation par voie aqueuse
On utilise l'hypochlorite de sodium, qui va agir comme oxydant doux :
\(\textrm{Na}^+ \textrm{(aq)}+\textrm{ClO}^- \textrm{(aq)}+2.\textrm{NH}_3 \textrm{(aq)} \to \textrm N_2\textrm H_4 \textrm{(aq)} + \textrm{Na}^+ \textrm{(aq)}+\textrm{Cl}^- \textrm{(aq)}\)
Complément : L'hypochlorite de sodium
L'hypochlorite de sodium \(\textrm{Na}^+\textrm{ClO}^-\) est un composé contenant du chlore au degré d'oxydation +I, susceptible de se réduire en revenant au degré d'oxydation 0 (\(\textrm{Cl}_2\)) ou −I (\(\textrm{Cl}^-\)).
Propriétés physiques
L'hydrazine est liquide à la pression atmosphérique et à température ambiante, \(T_f=2 °\textrm C\textrm{ }\textrm{(271 K)}\), \(T_{eb}=113\textrm,3 °\textrm C\textrm{ }\textrm{(386 K)}\)
Comparez avec\( \mathrm{NH}_3\) :\( T_f=-77,7°\mathrm{C}(195,4~\mathrm{K})\); \(T_{eb}=-33,3°\mathrm{C}(239,8~\mathrm{K})\)
La molécule est non-polaire par symétrie, mais il y a un dipôle pour chaque moitié, qui peut amener à des liaisons hydrogène et donc une interaction assez forte avec l'eau, comme pour \(\textrm{NH}_3\), donc une forte solubilité.
Propriétés chimiques
Elle est instable thermiquement à partir de \(200 °\textrm C\) :
\(\mathrm{N_2H_4(g)\to~N_2(g)+2~H_2(g)}~~~\Delta~H°_{298K}=-95,0~\mathrm{kJ.mol^{-1}}\)
C'est un réducteur énergique. Par exemple, sur le diiode :
\(\textrm N_2\textrm H_4 \textrm{(l)}+2.\textrm I_2 \textrm{(s)}\to \textrm N_2 \textrm{(g)} + 4.\textrm{HI} \textrm{(g)}\)
ou sur le dioxygène (oxydation spontanée à l'air) :
\(\mathrm{N_2H_4(g)+O_2(g)\to~N_2(g)+2~H_2O(l)}~~~\Delta~H°_{298K}=-534\mathrm{kJ.mol}-1\)
C'est une base, mais moins forte que \(\textrm{NH}_3\) :
\(\textrm N_2\textrm H_4+\textrm H_2\textrm O\to \textrm N_2\textrm H_5^+ + \textrm{OH}^-\textrm{ }\textrm{ }pK_b=7\)
\(\textrm N_2\textrm H_5^+\) est l'ion hydrazinium ; on stabilise l'hydrazine sous forme de sulfate ou de chlorure d'hydrazinium.
Il y a une analogie avec l'ion ammonium.
Complément : L'ion ammonium
\(\mathrm{NH_3+H_2O\to~NH_4^++OH^- ~~~pK_b=4,75\left(\textrm{à}~ 25°C\right)}\)