Propriétés oxydo-réductrices
L'ammoniac est plus réducteur et moins oxydant que l'eau (\(\textrm H_2\textrm O\)).
Complément : Evolution des propriétés
La valeur élevée de l'électronégativité de l'élément central confère à ces hydrures des propriétés oxydantes. Comme l'azote est moins électronégatif que l'oxygène, il est donc normal que \(\textrm{NH}_3\) soit moins oxydant que \(\textrm H_2\textrm O\).
Il y a deux réactions principales d'oxydation en voie sèche :
\(\mathrm{NH_3~+~\frac{3}{4}O_2}\Leftrightarrow~\frac{1}{2}\mathrm{N_2+\frac{3}{2}H_2O}~~~\Delta~H°_{298K}= -300~\mathrm{kJ.mol^{-1}}\)
\(\mathrm{NH_3~+~\frac{5}{4}O_2}\Leftrightarrow~\mathrm{NO+\frac{3}{2}H_2O}~~~\Delta~H°_{298K}= -214~\mathrm{kJ.mol^{-1}}\)
La première est favorisée au détriment de la seconde, mais elle n'a aucun intérêt.
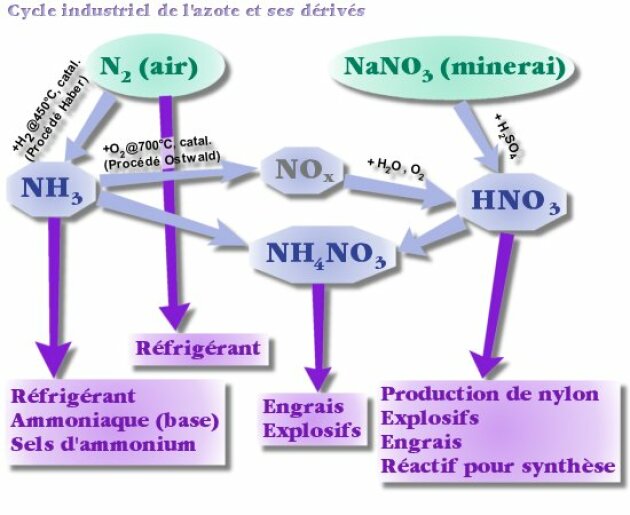
Par contre, la seconde est une étape-clé dans la fabrication de l'acide nitrique et des nitrates. Pour la favoriser (cinétiquement), on utilise un catalyseur (du platine rhodié) à \(700 °\textrm C\) : c'est la synthèse d'Ostwald.
En milieu aqueux, l'ammoniac peut être oxydé, principalement par des bactéries, ce qui facilite l'incorporation d'azote par les plantes, mais en cas d'excès, peut amener à des pollutions...