Propriétés acido-basiques
Comme \(\textrm{NH}_3\) est une base de Lewis assez forte (plus forte que \(\textrm H_2\textrm O\)), ce qui entraîne son caractère de base de Brönsted (c'est-à-dire au sens usuel, capteur de \(\textrm H^+\)) sur l'eau :
\(\textrm{NH}_3 + \textrm H_2\textrm O \to \textrm{NH}_4^+ + \textrm{OH}^-\)
\(\mathrm{pK_b=4,75~\left(\textrm{à}~25°C\right)}\)
L'ammoniac est donc une base faible, car son \(pK_b\) est compris entre 2 et 12. Il y a donc plus de \(\textrm{NH}_3\) dissous que de \(\textrm{NH}^+_4\) lorsqu'on n'altère pas le \(\textrm{pH}\).
L'acide conjugué de \(\textrm{NH}_3\) est l'ion ammonium \(\textrm{NH}^+_4\) : celui-ci est également faible dans l'eau (\(pK_a = 14 - pK_b = 9\textrm,25\)). Sa structure est analogue à celle de \(\textrm{CH}_4\) (tétraèdre régulier, angles exactement de 109°28').
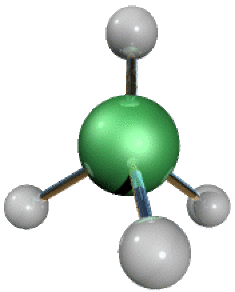
Au vu de sa symétrie et ses dimensions, il a beaucoup de propriétés analogues aux ions alcalins de taille élevée (\(\textrm K^+\) , \(\textrm{Rb}^+\)). On connaît donc de nombreux sels d'ammonium similaires aux sels de métaux alcalins (par exemple \(\textrm{NH}_4\textrm{Cl}\), de type \(\textrm{NaCl}\) ou \(\textrm{CsCl}\)).