Propriétés de solvant
L'ammoniac liquide est le solvant non-aqueux le plus utilisé de tous. De façon similaire à l'eau, il est polaire, mais dans une moindre mesure. Il peut cependant se retrouver tel quel dans des cristaux, comme « l'eau de cristallisation » (par exemple \(\textrm{CaCl}_2 \bullet 8.\textrm{NH}_3\), tout comme \(\textrm{Ca(NO}_3\textrm)_2 \bullet 4.\textrm{H}_2\textrm O\)).
Il est également capable d'auto-dissociation :
\(2.\textrm{NH}_3\Leftrightarrow \textrm{NH}_4^++\textrm{NH}_2^-\textrm{ }\textrm{ }pK_n =33\)
\((\textrm{comparer avec}\textrm{ }2.\textrm H_2\textrm O \Leftrightarrow \textrm H_3\textrm O^++\textrm{OH}^-\textrm{ }\textrm{ }pK_e=14)\)
La base conjuguée de \(\textrm{NH}_3\) est l'ion amidure \(\textrm{NH}_2^-\), c'est la base la plus forte pouvant exister dans \(\textrm{NH}_3\) liquide. Bien entendu, l'amidure est une base forte dans l'eau :
\(\textrm{NH}_2^- + \textrm H_2\textrm O \to \textrm{NH}_3+\textrm{OH}^-\)
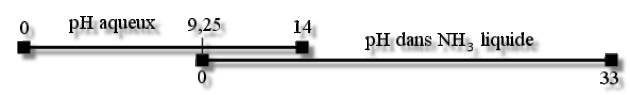
On peut donc manipuler dans \(\textrm{NH}_3\) liquide des bases plus fortes que \(\textrm{OH}^-\) sans les niveler. L'échelle de \(\textrm{pH}\) y est plus étendue (de 0 à 33, le zéro correspondant à un \(\textrm{pH}\) aqueux de 9).
Des bases encore plus fortes que \(\textrm{NH}^-_2\) sont l'ion imidure \(\textrm{NH}^{2-}\) et l'ion nitrure \(\textrm N^{3-}\). Les amidures et imidures solides peuvent se transformer en nitrures par simple chauffage.
Une propriété très différente de celle de l'eau est la possibilité de solvater un électron :
\(\textrm{Na}\textrm{(s)} \to \textrm{Na}^+\textrm{(solv)} +\textrm{e}^-\textrm{(solv)}\)
Celui-ci confère une couleur bleue à la solution. Il peut être utilisé pour des réductions ménagées impossibles dans l'eau.