Propriétés complexantes
Le caractère de base de Lewis (don de doublet) se retrouve dans la réactivité vis-à-vis des cations de métaux de transition (qui sont des acides de Lewis, accepteurs de doublet), pour former des complexes métal-ligand :
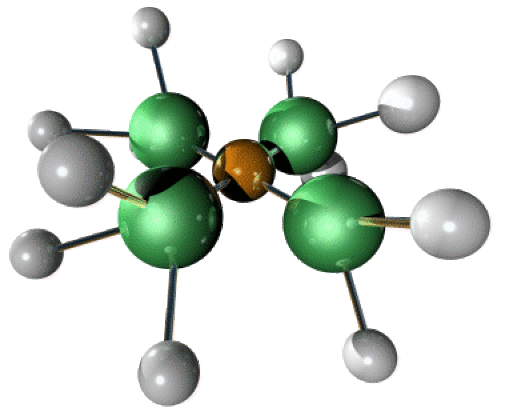
\([\textrm{Cu(NH}_3\textrm)_4]^{2+}\), plan carré
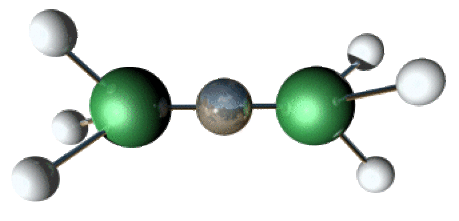
\([\textrm{Ag(NH}_3\textrm)_2]^+\) linéaire
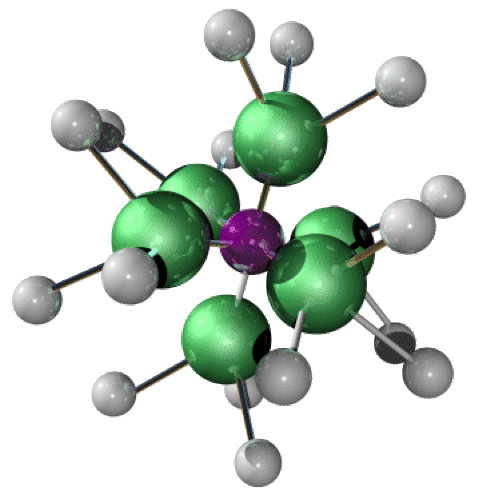
\([\textrm{Co(NH}_3\textrm)_6]^{3+}\), octaédrique (le plus souvent)
\(\textrm{NH}_3\) est un ligand plus fort que l'eau (\(\textrm H_2\textrm O\)), mais moins fort que \(\textrm{NO}^-_2\) ou \(\textrm{CN}^-\).
Complément : L'eau ligand
Dans le cas des cations petits et chargés (acide de Lewis forts), la molécule d'eau joue le rôle de ligand (base de Lewis). Il y a alors formation d'ions complexes de géométrie définie par le nombre de ligands \(\textrm H_2\textrm O\) fixés sur le cation central : généralement 2, 4 ou 6, conduisant à des complexes linéaires, tétraédriques ou plans carrés et octaédriques. \(\textrm H_2\textrm O\) est cependant un ligand de force moyenne et pourra aisément être substitué par des ligands plus forts tels \(\textrm{NH}_3\), \(\textrm{NO}^-_2\), \(\textrm{CN}^-\), etc.