Structure de la molécule et propriétés moléculaires
Schéma de Lewis
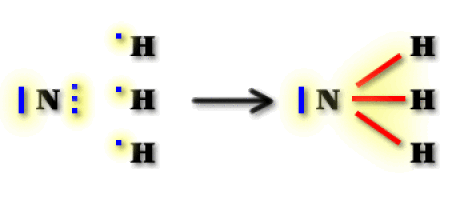
Géométrie des orbitales moléculaires selon la théorie VSEPR
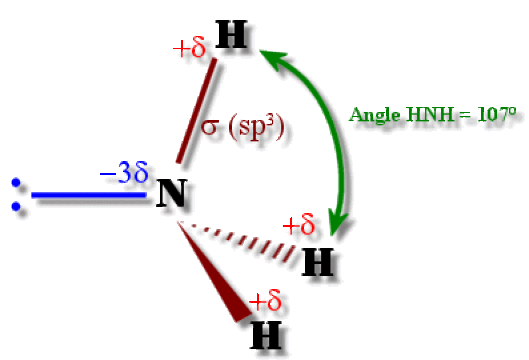
Par la théorie de Gillespie, on prévoit un type structural \(\textrm{AX}_3\textrm E\), avec une hybridation \(\textrm{sp}^3\) de l'azote. Le doublet libre étant de localisation plus proche de l'azote que les doublets liants, celui-ci les repousse ; l'angle \(\textrm{HNH}\) est donc inférieur à 109°28'.
Comme \(\textrm N\) est plus électronégatif que \(\textrm H\), il y a un excès de charge négative sur celui-ci. La molécule possède donc un moment dipolaire.
\(\mu = 1\textrm,47 \textrm D (1 \textrm{D} =3\textrm,336\textrm.10^{-30} \textrm{C.m})\)
En fait, dès que la température est suffisante, il y a un mouvement rapide de \(\textrm N\) qui passe plusieurs millions de fois par seconde de part et d'autre du plan formé par les 3 \(\textrm H\).
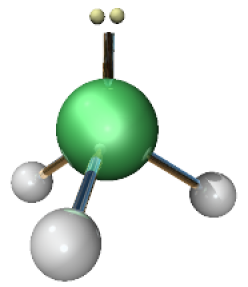
Structure de la molécule d'ammoniac
Diagramme d'orbitales moléculaires de la molécule d'ammoniac
Il y a 4 doublets, dont un (\(\sigma_Z\)), qui est non-liant lorsque \(\textrm N\) est au milieu des 3 \(\textrm H\), et davantage liant lorsque l'angle fait 107°. Ceci suffit pour expliquer le caractère de Base de Lewis (donneur de doublet) de l'ammoniac.
La distance interatomique est \(d\left(\mathrm{N-H}\right)=1,01~\AA\)