L'atome d'oxygène
L'oxygène possède trois isotopes principaux : \(\textrm{}^{16}\textrm O\) présent naturellement à \(99,759\%\), \(\textrm{}^{17}\textrm O\) présent à \(0,0374\%\) et \(\textrm{}^{18}\textrm O\) présent à \(0,2039\%\). Ces isotopes sont séparés par distillation fractionnée de l'eau. Les isotopes sont très utiles en recherche : \(\textrm{}^{17}\textrm O\) ayant un spin nucléaire non nul \(\left(\frac{5}{2}\right)\), il est utilisé pour des déterminations de structure par RMN (Résonance Magnétique Nucléaire). L'oxygène \(\textrm{}^{17}\textrm O\) sert de marqueur dans l'étude de nombreux mécanismes réactionnels et processus de diffusion.
Son numéro atomique est \(Z=8\) et sa structure électronique est : \(1\textrm s^22\textrm s^22\textrm p^4\). Il possède donc six électrons périphériques.
Son électronégativité est élevée : elle est de \(\chi=\textrm{3,5}\) suivant l'échelle de Pauling et se situe juste derrière celle du fluor (\(\chi=4\)). Ceci résume la capacité de l'oxygène à capter des électrons et explique pourquoi l'oxygène donne des composés avec tous les éléments sauf \(\textrm{He}\), \(\textrm{Ne}\) et \(\textrm{Ar}\). Le degré d'oxydation de l'oxygène le plus fréquemment rencontré est -II Dans ce cas, il y a fixation totale (ion \(\textrm O^{2-}\)) ou partielle de deux électrons (pour atteindre la configuration du gaz rare le plus proche ( \(\to\textrm{Ar}\)). En revanche, dans le cas des fluorures d'oxygène \(\textrm F_2\textrm O\) et \(\textrm F_2\textrm O_2\) on peut rencontrer les degrés d'oxydation +I ou +II pour l'oxygène.
Les énergies d'ionisation sont les suivantes :
\(\textrm{O (g)}~^{\to}_{\gets}~\textrm O^+ \textrm{(g)}+\textrm e^-\textrm{ }\textrm{ }\Delta H_{\textrm{ion}}\textrm{ (+I)}=1421 \textrm{kJ.mol}^{-1}\)
\(\textrm{O (g)}~^{\to}_{\gets}~\textrm O^{++} \textrm{(g)}+2\textrm e^-\textrm{ }\textrm{ }\Delta H_{\textrm{ion}}\textrm{(+II)}=3381 \textrm{kJ.mol}^{-1}\)
donc, il n'existe pas de composés contenant les ions \(\textrm O^{+}\) ou \(\textrm O^{++}\) .
Les affinités électroniques sont les suivantes :
\(\textrm{O (g)}+\textrm e^-~^{\to}_\gets~\textrm O^- \textrm{(g)}\textrm{ }\textrm{ }\Delta H_{\textrm{aff}}\textrm{(-I)}=-146 \textrm{kJ.mol}^{-1}\)
\(\textrm O^- \textrm{(g)}+\textrm e^-~^{\to}_{\gets}~\textrm O^{--} \textrm{(g)}\textrm{ }\textrm{ }\Delta H_{\textrm{aff}}\textrm{(-II)}=+856 \textrm{kJ.mol}^{-1}\)
L'oxygène participe à des liaisons iono-covalentes : ces liaisons peuvent être très ioniques lorsque la différence d'électronégativité \(\Delta\chi\) est élevée (ex. \(\textrm{MgO}\)), à très covalentes lorsqu'elle est faible (ex. \(\textrm{ClO}\)). En tout cas, à cause de la forte électronégativité de \(\textrm O\), elles ne sont presque jamais métalliques. Différents types d'hybridation sont alors possibles :
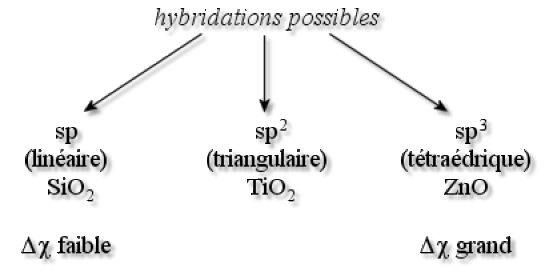
L'oxygène peut également former des liaisons simples, covalentes (ex. \(\textrm H_2\textrm O\)) ou multiples (ex. \(\textrm{CO}_2\) avec \(\textrm O=\textrm C=\textrm O\) ).